生物3D打印神经样纤维可以改善生态微环境从而促进大段脊髓损伤再生
时间:2023-03-30 10:11 来源:上普生物 作者:admin 阅读:次
生物3D打印在以自下而上的装配方式制造仿生活性结构体方面具有巨大的前景。近日,一篇名为“3D
bio-printed living nerve-like fibers refine the ecological niche for
long-distance spinal cord injury
regeneration”的文章由清华大学的王秀梅教授研究团队在Bioactive Materials
(IF=16.87)上发表。该文章通过基于挤压式生物3D打印技术制备了活体神经样纤维用于脊髓损伤治疗。活体神经样纤维由神经干细胞(NSCs)组成,大量神经干细胞被包裹在一种模拟细胞外间质(ECM)的水凝胶内,组装成一种高度空间有序的结构,形似于密集排列的神经纤维束。通过4mm大段完全横断脊髓损伤大鼠模型测试了活体神经样纤维的促神经发生能力。研究显示,活体神经样纤维通过免疫调节、血管生成、神经发生、神经中继形成和神经回路重塑来改善缺陷部位的生态微环境,完成了出色的功能重建,揭示了植入后活性结构的演变过程,为脊髓损伤的临床治疗提供了新思路。

背景介绍
脊髓损伤是一极为严重的中枢神经系统破坏,可能导致永久性运动和感觉功能障碍,给患者带来巨大的身体和心理痛苦还有沉重的经济负担。为了恢复脊髓损伤后被破坏的神经功能,临床上使用了包括手术,药物,细胞治疗,生物材料植入和物理刺激在内的巨大努力致力于重建神经回路和损伤后的神经元通信,但效果仍然远远不能令人满意。治疗效果有限的主要原因是损伤部位的不利于生态微环境逐渐形成,伴随着内源性促进剂不足,神经元丢失,轴突恶化和脱髓鞘,缺血,神经炎症和胶质瘢痕形成等一系列病理事件。因此,如何改善整个损伤部位的生态微环境已被视为脊髓损伤治疗的关键战略目标。
在过去的二十年中,神经干细胞(NSCs)移植已经成为一个令人鼓舞的脊髓损伤治疗方案,因为神经原性和神经保护的双重功能。人们普遍认为,植入的具有自主分化能力的NSCs可以补充受损的细胞,并分泌大量的神经营养因子作为活的“生物工厂”来滋养微环境,产生新生的神经回路和进一步修复功能。此外,植入的神经干细胞可以诱导内源性神经干细胞迁移到病变部位以促进脊髓再生。尽管神经干细胞移植是一种有效的修复策略,但它通常面临不利于生存的炎症微环境,导致留存率低,细胞存活率低,迁移分化不受控制等安全性问题,大大减少了治疗效果。值得注意的是,体内神经干细胞位于一个特定的三维(3D)微环境,其中包括与相邻细胞、可溶性因子和细胞外间质(ECM)的高度活跃的相互作用,为NSC粘附提供结构支持,并为调节细胞功能和基质沉积的信号转导提供平台。脊髓损伤后,典型的 ECM 结构和功能受到严重破坏。因此,生物材料支架作为一种人工细胞外基质是必不可少的,以重建有利微环境和调节细胞群组织再生。以生物材料为基础的干细胞移植作为一种有希望的脊髓损伤治疗方法已经受到广泛关注,该方法有助于在移植后调节干细胞功能,并避免细胞治疗的缺点。

实验过程与结果
生物墨水的选取与表征
考虑到中枢神经系统的天然 ECM 成分,该文章设计了一种明胶和透明质酸组成的混合水凝胶,以创建特定的生态微环境。将明胶和透明质酸分子骨架与甲基丙烯酰基进行化学功能化,合成了接枝度分别为60%和18%的 GelMA和HAMA。该材料可以通过光聚合后的碳-碳双键(1640cm-1)共价共轭在一起,形成一个混合网络。GelMA(5%w/v)和 HAMA(1%w/v)的复合材料在25-28°C 附近表现出明显的热响应行为与粘度的急剧下降,证明其溶胶-凝胶转变在28°C,同时,材料体系在28°C 时表现出典型的剪切变稀行为,这对于保护打印过程中的细胞免受剪切力损伤是必要的。此外,GelMA/HAMA 溶液在紫外线(UV)照射下可发生快速凝胶化过程。因此,生物墨水具有良好的可打印性,结合温敏交联和光交联,可以很容易地制造各种高精度结构体。

载神经干细胞生物墨水的生物3D打印和表征
从胚胎 SD大鼠的海马体中分离出神经干细胞,并用巢蛋白抗体进行鉴定。为了评估3D 生物打印后 GelMA/HAMA 中NSC的细胞活性和功能,制备高细胞密度(107/mL)的 NSC 载体生物墨水,并在进行生物3D打印以形成活性结构体,转移到培养基中并在培养箱中培养。通过 Live/Dead 染色测定在体外评估构建体内 NSCs 的活力,其在打印后结构体极高的活性(94.69%±2.35%) ,并且在7天后仍然可以维持高活性水平。为了追踪包裹在活体结构体中的神经干细胞的形态,研究在3天的细胞培养后进行了细胞骨架染色。结果表明,GelMA/HAMA 水凝胶能明显拉长丝状伪足,为神经干细胞的粘附和扩散提供了合适的生态微环境。此外,用 RT-PCR 监测神经干细胞的分化行为。神经干细胞的干细胞特异性基因巢蛋白和 SRY-box 转录因子2(Sox2)在含有增殖培养基的3D水凝胶中的表达远高于其他组的神经干细胞,表明3D水凝胶可以在无血清环境中维持神经干细胞的自我更新和多能性。相比于不含生长因子的平面培养,水凝胶中的神经干细胞表达了更高的神经元特异性基因 βIII 微管蛋白(Tuj-1),和更低的胶质纤维酸性蛋白(GFAP)表达。同时进行免疫荧光染色以观察神经干细胞在三维水凝胶内的分化行为(图3 d-f) 。更多的 Tuj-1阳性神经元和相对较少的 GFAP 阳性星形胶质细胞在水凝胶内产生,三维环境赋予了被包裹的神经干细胞状态依赖性的细胞行为,以调节干细胞维持和神经元分化的协调性。此外,细胞内的钙信号在细胞功能和各种神经元的信号转导方面起着关键作用。为了确定从神经干细胞分化出来的神经元是否在3D 结构中起作用,研究在培养2周后进行了 Fou-4钙成像测试。将细胞与Fou-4 染料孵育后,用共聚焦显微镜监测荧光强度,并记录其对谷氨酸神经递质的反应。在添加谷氨酸67秒后捕获钙瞬变,这表明神经元功能活跃,能够通过自发活动传递信号。作为一种活性结构体,神经干细胞3D 水凝胶有望为其他神经元的粘附和生长提供一个合适的生态微环境,这可能会显著影响宿主和移植物之间的整合。

体内免疫微环境的调节
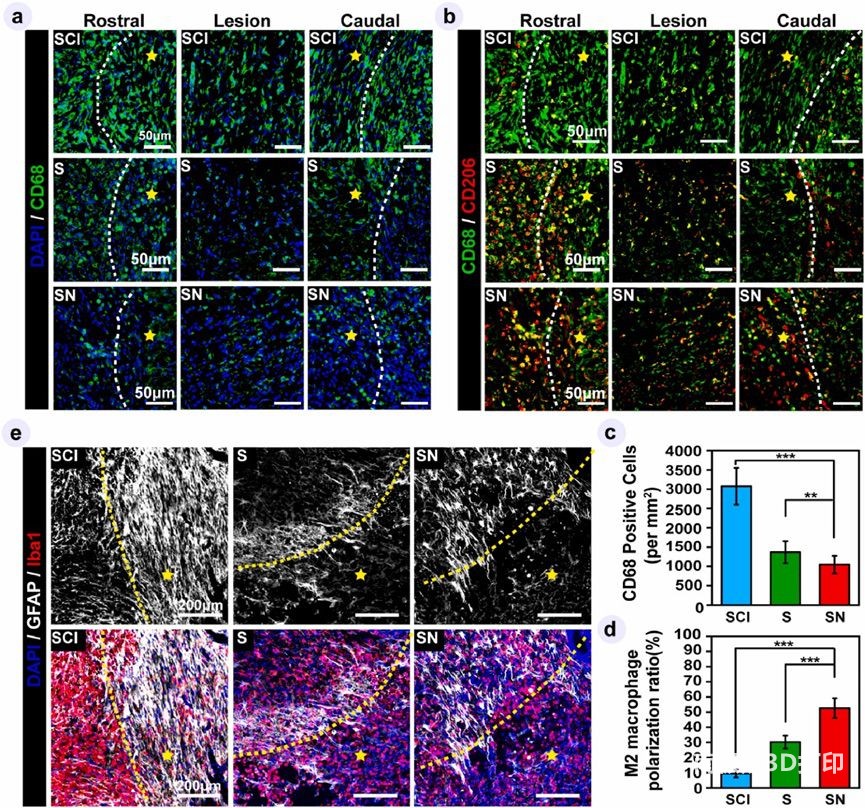
将大鼠随机分为3组,将不含细胞3D水凝胶(支架组,S组)或载NSC-3D生物支架(载NSC支架组,SN组)植入病变部位填充空腔,以不植入任何内固定物的未处理脊髓损伤组作为对照组(SCI组)。脊髓损伤可能引起一系列炎症事件,并在损伤后7天达到高峰。在这种情况下,炎症微环境对于移植的神经干细胞在体内的存活及其长期的神经修复作用具有至关重要的意义。小胶质细胞/巨噬细胞是脊髓损伤后炎症过程中的关键调节细胞。因此,研究进行了 CD68免疫荧光染色来表征总巨噬细胞/小胶质细胞的活化,并与 CD206共标记,以定位 M2极化的巨噬细胞/小胶质细胞。巨噬细胞表型从促炎 M1向抗炎 M2的转变在指导组织修复中尤为重要。然而,这种转变在脊髓损伤中通常是停滞不前的。在该研究中,研究发现 S 组相比于比SCI组而言活性巨噬细胞数量显着减少,M2巨噬细胞比例显着增加,表明植入 ECM 样支架有利于炎症调节功能。这些结果可以通过植入的支架的机械性能,具有适当孔隙率和仿生ECM组分可调节巨噬细胞的浸润和极化来解释。与 S 组相比,SN 组活化的巨噬细胞数量显着减少,M2巨噬细胞百分比显着提高,表明活神经样纤维内的 NSCs 也显示出显着的抗炎功能,这可能是由炎性细胞因子和 NSCs 分泌的细胞因子之间的复杂相互作用引起。此外,先前的研究表明,核酸药物重编程的雪旺细胞可以通过增强的细胞间通讯促进巨噬细胞进入 M2表型,这证明了细胞间通信(cell-cell crosstalk)在调节免疫信号传导中的重要性。ECM 样水凝胶和负载的 NSCs 协同作用,导致损伤后免疫微环境中细胞-细胞通讯和细胞-生物材料相互作用的增强,这可以有效地指导募集的巨噬细胞进入 M2表型并减轻局部炎症反应。总的来说,活体神经样纤维通过水凝胶和 NSCs 对炎症微环境的协同反应呈现出突出的免疫调节功能,有助于加速从促炎症到抗炎的炎症状态,并将受损组织推向修复和再生。星形胶质细胞现在被认为是脊髓损伤后重塑的参与者,它可以被激活并对炎症环境作出反应。为了研究活体神经样纤维在急性炎症阶段如何调节星形胶质细胞,研究分别用胶质纤维酸性蛋白(GFAP)和 Iba-1标记星形胶质细胞和小胶质细胞/巨噬细胞。值得注意的是,在 SCI 组中,大量活化的星形胶质细胞已经迁移到病变部位并形成致密的壁状构造,并且创建了隔离相邻宿主脊髓和病变核心的栅栏样边界。这种由强烈激活的星形胶质细胞形成的壁状结构可能构成轴突生长的物理和化学屏障。相反,在 S 和 SN 组中,在病变边缘发现松散排列的星形胶质细胞以桥式模式连接宿主脊髓和植入物,表明星形胶质细胞由于抑制巨噬细胞活化处于幼稚状态而不是瘢痕形成状态。此外,这种桥状星形胶质细胞可以作为一个支持的备用轴突,有助于神经网络重建。
重建新生神经元的生态微环境
由反应性胶质瘢痕分泌的硫酸软骨素蛋白聚糖(CSPGs)已被证明是轴突重塑的主要抑制剂,导致脊髓损伤后神经再生失败。研究进一步分析了CSPG对不同组中轴突生长锥的抑制作用,在损伤后12周,通过染色 CS-56来标记CSPG,并染色GAP43来标记轴突生长锥。在脊髓损伤组,大量CSPG沉积在损伤部位形成密集的化学屏障,阻碍宿主神经跨界生长进入损伤部位。此外,放大的图像表明,再生轴突停止在 CSPG 丰富的区域。这是因为轴突生长锥对微环境的特征高度敏感。一旦他们到达病变核心含有丰富的CSPG,他们停止生长和由于营养不良收缩成球。由于ECM样水凝胶的免疫调节作用,S组CS-56阳性面积明显减少,并且在损伤边界上观察到一些出芽的轴突。值得注意的是,SN组中CS-56阳性区域很少,而是以相对对齐的模式被高密度的 GAP43阳性轴突取代,这表明在病变部位正在进行较好的神经轴突再生。
由于新生神经元经历增殖,轴突延伸和神经网络形成,需要同步血管化来满足神经组织再生过程中营养物质和代谢交换的需求。因此,为损伤部位创造一个再生的神经血管生态微环境对于新生神经元功能化和组织再生至关重要。为了进一步了解活体神经样纤维的协同再生作用,通过在损伤后12周对 Tuj-1和大鼠内皮细胞抗原-1(RECA-1)进行免疫染色来观察新生神经元和血管。在 S 组和 SN 组的病变部位可以观察到更均匀分布的 RECA-1和 Tuj-1阳性细胞,表明新生神经元受到营养结构的支持。值得注意的是,SN 组的共焦 z 叠加图像显示有一些新生血管具有管腔样结构,在病变部位的新生神经元周围均匀再生,这为新生神经元向功能化方向发展奠定了基础。结果表明,活体神经样纤维通过减少抑制性化学屏障的产生和重建血管系统,优化了新生神经元的生态位,有助于维持其可持续的功能。

神经再生和髓鞘再生
对于打算脊髓损伤修复,损伤核心神经元的补充是神经回路重建的基础。为了鉴定和评估不同处理的完整横断脊髓的神经元再生能力,研究对神经元 III 类 β-微管蛋白(Tuj-1)进行免疫染色以显现新生神经元,生长相关蛋白-43(GAP43)以显现再生出芽轴突和神经丝200(NF)以检测成熟的神经纤维。SN组损伤部位有丰富的再生 Tuj-1阳性细胞,与 S组(P<0.01)和SCI组(P<0.001)相比显着增加。同时,S组由于ECM 样水凝胶的免疫调节作用,减少了瘢痕组织的形成,从而使多余的神经元迁移到损伤部位。而活体神经样纤维不仅为存活体神经元建立了良好的生态位,而且从原位神经干细胞的神经发生中补充了大量的神经元。轴突的生长方向是高度敏感的,并且通过整合外部线索使其终端树枝状朝向正确的目标。 SCI和S组相比,SN组中的GAP43阳性轴突以相对均匀和定向的模式排列,这可能是由于在印刷纤维中均匀分布的 NSCs 的高密度可以作为指导神经元通过直接接触或旁分泌手段延伸的方向。GAP43阳性轴突的定量分析表明,与SCI(P<0.001)和S组(P<0.001)相比,SN组具有最高的出芽轴突密度,这表明3D 打印的活神经样纤维提供的再生轴突的理想生态位(图6b8)。最重要的是,与SCI和S组相比,丰富的神经纤维不仅在病变边缘而且在病变核心处再生,并且在 SN组中连续分布(图6a9) ,表明活体神经样纤维的均匀,快速和强大的神经再生能力。这些结果表明,ECM样水凝胶和充足的神经干细胞组装的活体神经样纤维3D 为更好的神经再生提供了一个优越的平台。

髓鞘包裹轴突,使轴突电绝缘,提高神经传导的速度和准确性,同时为轴突提供营养支持和保护,所以髓鞘再生在重建神经元信号转导系统中起关键作用。在损伤后12周,通过甲苯胺蓝染色和透射电子显微镜(TEM)分别检查所有组中神经损伤部位的半薄和超薄切片。在SN组中,大部分再生神经纤维被髓鞘包裹。相比之下,S组的神经纤维显示出大量的再生轴突,而髓鞘小而薄。此外,在脊髓损伤组,很少有再生轴突和髓鞘。定量分析显示,SN组有髓神经纤维密度(20225±2747神经/mm2)显着高于 S组(9092±3228神经/mm2,P <0.001)和 SCI组(2918±656神经/mm2,P<0.001)(图7c)。为了进一步评估再髓鞘形成的程度,使用 TEM 通过超微结构分析计算基于面积的 G 比率(轴突面积/整个有髓轴突面积) ,并通过箱形图(图7d)和散点图(图7e)呈现。SN 组面积比(0.42±0.06)显著低于S组(0.53±0.04,P<0.001)和 SCI组(0.61±0.44,P<0.001) ,表明髓鞘再生相对成熟。此外,与 S组和 SCI组相比,SN 组的再生神经纤维显示更大的有髓神经纤维,反映了活神经纤维的持续促髓鞘形成能力。然后,研究分别使用髓鞘基础蛋白(MBP,表示髓鞘)和 NF (表示神经纤维)在病变部位通过 IF染色纵向和横向切片观察轴突的髓鞘形成。在 SN 组中,纵切片的Z叠加共定位图像显示再生的神经纤维包裹着密集和有组织的髓磷脂,并且 z切片显示由髓磷脂环绕神经纤维组成的典型的“壳核”结构。相比之下,这种结构在 S 组中不太普遍,在 SCI 组中偶尔出现。这些结果提示支架移植能促进轴突再生,但再生轴突不足,髓鞘重建不足。同时,活体神经样纤维移植到损伤部位可显著促进轴突再生和髓鞘再生。

神经中继形成和功能性神经网络重构
外源性 NSCs 衍生的神经元可以通过形成突触连接作为宿主脊髓和病变部位之间的“信号中继站”,这被认为是严重 SCI 修复的有希望和有效的策略。损伤后12周,研究用 NF 和 SYN (突触前标记物突触素 I)标记受损脊髓的纵向冷冻切片,从而可视化再生神经纤维之间的突触形成。此外,在SN组中,GFP被用来区分移植细胞和宿主细胞。IF染色结果显示,移植到损伤部位的活体神经样纤维在整个损伤部位实现了广泛和强大的神经纤维再生。同时,在SN组病变核心有许多有序的 GFP/NF 共阳性(指移植来源的神经元)和一些 NF 阳性神经纤维(指宿主神经元)。这些纤维密切接触,并已检测到高密度SYN信号,表明新生突触来源于移植物和宿主神经元。透射电镜显示SN组再生突触的超微结构。此外,新生轴突中形成的再生突触百分比的定量分析显示 N (3.40±1.36%)和SN(10.79±3.62%)组之间有显著差异(P<0.001), SN组中的再生神经元具有改善的连接性。总的来说,这些结果表明,活体神经样纤维可以在病变部位建立外源性神经元中继,并与宿主神经元整合,有助于传递来自脊髓上下行通路的信号。
为了探索新生神经元网络的功能,研究通过染色胆碱乙酰转移酶(chAT) ,酪氨酸羟化酶(TH)和血清素(5-HT)分别鉴定了胆碱能,多巴胺能和5-羟色胺能轴突的再生。在SN组,结果显示在病变部位有大量可见的NF和ChAT双染色的轴突,并且大部分共表达GFP。同样,病变部位连续和丰富的 NF 阳性轴突显示TH和GFP阳性信号。此外,Z叠层图像显示,与移植物分化的5-HT阳性轴突在病变核心表现出大约260μm 的延伸。相比之下,其他组在损伤部位很少观察到功能性神经元的染色。上述结果表明,活体神经样纤维内的神经干细胞可分化为与运动和感觉有关的功能性神经元。此外,在 SN组的病变部位也观察到一些非 GFP表达的功能性神经元(即宿主细胞) ,这可能是由于移植的活神经样纤维提供的微环境改善,导致一些内源性功能性神经元的募集。

功能恢复和安全评估
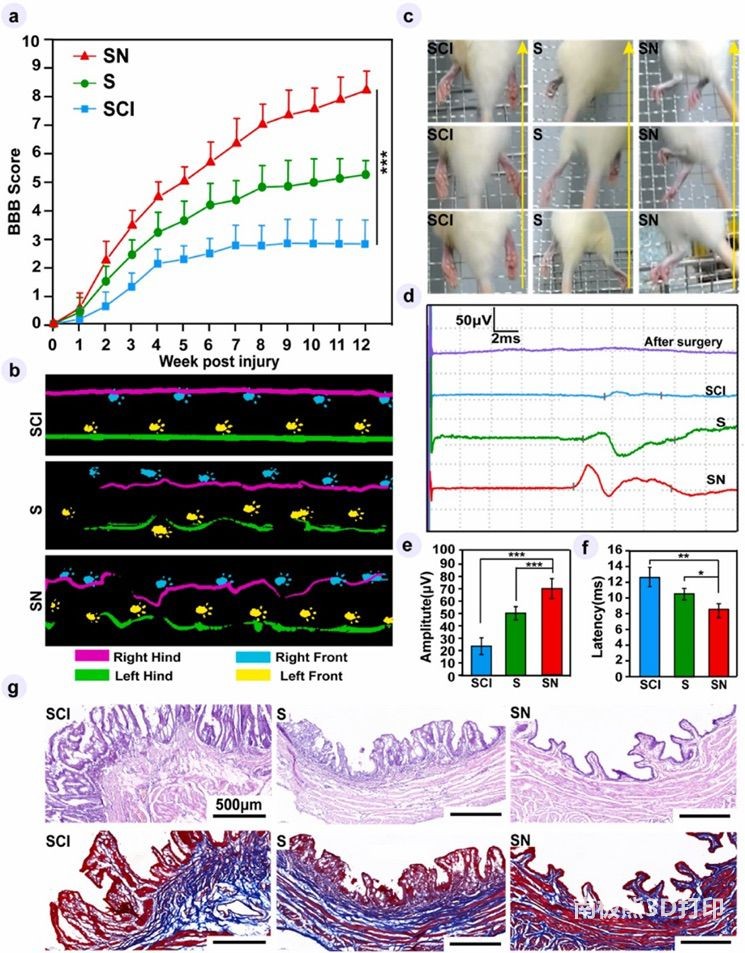
在 SCI 后,研究每周使用 Basso,Beattie 和 Bresnahan (BBB)评分来评估不同组大鼠的运动恢复情况(图9a)。与对照组(N组和SCI组)相比,SN组大鼠表现出统计学上显著的进行性运动恢复。此外,对于 SN组,手术后(0周)大鼠已经从完全瘫痪恢复,平均在伤后12周时偶尔承重背部踏步(中位BBB评分=9)。研究使用Catwalk 分析(图9b)和倾斜网格试验进一步评估了伤后12周自主和协调的运动功能恢复。SCI组大鼠的足迹显示出线状模式,表明后肢持续拖动(图9b) ,与网格测试结果一致,共同表现出运动功能的负恢复。然而,S组大鼠可以间歇性地将后肢抬离地面(图9b) ,并且在网格上爬行时呈现后肢适度的自主运动,而很少承重。值得注意的是,相比之下,SN组大鼠在 Catwalk 分析中表现出更明显的间歇性足迹(图9b) ,同时在爬坡过程中出现频繁的足底踏步和偶尔的前肢-后肢协调(图9c,视频 S3)。此外,在三个不同组的大鼠中进行经颅电生理测试以激发MEP,MEP是运动信号传导能力的可靠指标(图9d)。结果显示,按照SCI,S和 SN组大鼠的顺序,MEP幅度显着增加,而 MEP 潜伏期缩短(图9e-f) ,表明在 SN 组中,损伤部位的再生神经中继有效地促进了电信号的传导。总的来说,这些结果提供了活体神经样纤维移植能够使脊髓损伤后运动功能恢复的证据。
泌尿系统功能障碍是 SCI 常见但严重的并发症,并导致危及生命的后果。为了进一步研究不同治疗方法脊髓损伤后泌尿系统的变化,研究检查了大鼠膀胱和肾脏的病理学特征三组,伤后12周。结果表明,活体神经样纤维移植可以防止脊髓损伤大鼠膀胱粘膜水肿和肌束紊乱的病理损伤,这是由于其不仅在局部脊髓而且在全身具有显著的抗炎作用。肾组织的研究反映了类似的结果。这些研究结果表明,脊髓损伤大鼠活神经样纤维治疗,同时促进神经再生,也保护大鼠免受严重的泌尿系统并发症。
结论和展望
总的来说,生物3D打印的活体神经样纤维最大限度地发挥了神经干细胞在脊髓损伤修复中的治疗潜力。研究的研究结果提供证据表明,ECM样水凝胶保护外源性神经干细胞免受严酷的炎症环境,并为神经干细胞的长期存活,神经谱系分化和功能性突触形成提供了有利的生态微环境。此外,类 ECM水凝胶能够通过支持和粘附作用原位定位外源性神经干细胞,同时通过损伤部位的结构线索引导内源性神经元迁移。通过这种方式,宿主脊髓识别,接纳并整合外源性 NSCs衍生的再生神经回路,这表明3D打印的活体构建体可以在体内成熟为真正的活组织,实现了丢失组织的替换。由于三维生物打印活体神经样纤维的仿生结构和组成部分,ECM样水凝胶与携带的外源性神经干细胞协同作用,发挥出突出的生态微环境重建功能,协调有效的免疫调节、神经发生、血管形成、髓鞘再生、神经中继形成和神经回路重塑,共同促进了大段脊髓损伤修复和运动功能恢复。
参考文献
Yang J, Yang K, Man W, et al. 3D bio-printed living nerve-like fibers refine the ecological niche for long-distance spinal cord injury regeneration[J]. Bioactive Materials, 2023, 25: 160-175.
https://doi.org/10.1016/j.bioactmat.2023.01.023.

背景介绍
脊髓损伤是一极为严重的中枢神经系统破坏,可能导致永久性运动和感觉功能障碍,给患者带来巨大的身体和心理痛苦还有沉重的经济负担。为了恢复脊髓损伤后被破坏的神经功能,临床上使用了包括手术,药物,细胞治疗,生物材料植入和物理刺激在内的巨大努力致力于重建神经回路和损伤后的神经元通信,但效果仍然远远不能令人满意。治疗效果有限的主要原因是损伤部位的不利于生态微环境逐渐形成,伴随着内源性促进剂不足,神经元丢失,轴突恶化和脱髓鞘,缺血,神经炎症和胶质瘢痕形成等一系列病理事件。因此,如何改善整个损伤部位的生态微环境已被视为脊髓损伤治疗的关键战略目标。
在过去的二十年中,神经干细胞(NSCs)移植已经成为一个令人鼓舞的脊髓损伤治疗方案,因为神经原性和神经保护的双重功能。人们普遍认为,植入的具有自主分化能力的NSCs可以补充受损的细胞,并分泌大量的神经营养因子作为活的“生物工厂”来滋养微环境,产生新生的神经回路和进一步修复功能。此外,植入的神经干细胞可以诱导内源性神经干细胞迁移到病变部位以促进脊髓再生。尽管神经干细胞移植是一种有效的修复策略,但它通常面临不利于生存的炎症微环境,导致留存率低,细胞存活率低,迁移分化不受控制等安全性问题,大大减少了治疗效果。值得注意的是,体内神经干细胞位于一个特定的三维(3D)微环境,其中包括与相邻细胞、可溶性因子和细胞外间质(ECM)的高度活跃的相互作用,为NSC粘附提供结构支持,并为调节细胞功能和基质沉积的信号转导提供平台。脊髓损伤后,典型的 ECM 结构和功能受到严重破坏。因此,生物材料支架作为一种人工细胞外基质是必不可少的,以重建有利微环境和调节细胞群组织再生。以生物材料为基础的干细胞移植作为一种有希望的脊髓损伤治疗方法已经受到广泛关注,该方法有助于在移植后调节干细胞功能,并避免细胞治疗的缺点。

图1. 生物3D打印活体神经样纤维和新生功能网络体内重塑的示意图。
实验过程与结果
生物墨水的选取与表征
考虑到中枢神经系统的天然 ECM 成分,该文章设计了一种明胶和透明质酸组成的混合水凝胶,以创建特定的生态微环境。将明胶和透明质酸分子骨架与甲基丙烯酰基进行化学功能化,合成了接枝度分别为60%和18%的 GelMA和HAMA。该材料可以通过光聚合后的碳-碳双键(1640cm-1)共价共轭在一起,形成一个混合网络。GelMA(5%w/v)和 HAMA(1%w/v)的复合材料在25-28°C 附近表现出明显的热响应行为与粘度的急剧下降,证明其溶胶-凝胶转变在28°C,同时,材料体系在28°C 时表现出典型的剪切变稀行为,这对于保护打印过程中的细胞免受剪切力损伤是必要的。此外,GelMA/HAMA 溶液在紫外线(UV)照射下可发生快速凝胶化过程。因此,生物墨水具有良好的可打印性,结合温敏交联和光交联,可以很容易地制造各种高精度结构体。

图2. 支架的制造与表征。A-C)各种3D 打印结构。D)3D 打印网格。
E-F)3D 打印支架的扫描电镜图像。G-H)用平行线性阵列组装的支架。
载神经干细胞生物墨水的生物3D打印和表征
从胚胎 SD大鼠的海马体中分离出神经干细胞,并用巢蛋白抗体进行鉴定。为了评估3D 生物打印后 GelMA/HAMA 中NSC的细胞活性和功能,制备高细胞密度(107/mL)的 NSC 载体生物墨水,并在进行生物3D打印以形成活性结构体,转移到培养基中并在培养箱中培养。通过 Live/Dead 染色测定在体外评估构建体内 NSCs 的活力,其在打印后结构体极高的活性(94.69%±2.35%) ,并且在7天后仍然可以维持高活性水平。为了追踪包裹在活体结构体中的神经干细胞的形态,研究在3天的细胞培养后进行了细胞骨架染色。结果表明,GelMA/HAMA 水凝胶能明显拉长丝状伪足,为神经干细胞的粘附和扩散提供了合适的生态微环境。此外,用 RT-PCR 监测神经干细胞的分化行为。神经干细胞的干细胞特异性基因巢蛋白和 SRY-box 转录因子2(Sox2)在含有增殖培养基的3D水凝胶中的表达远高于其他组的神经干细胞,表明3D水凝胶可以在无血清环境中维持神经干细胞的自我更新和多能性。相比于不含生长因子的平面培养,水凝胶中的神经干细胞表达了更高的神经元特异性基因 βIII 微管蛋白(Tuj-1),和更低的胶质纤维酸性蛋白(GFAP)表达。同时进行免疫荧光染色以观察神经干细胞在三维水凝胶内的分化行为(图3 d-f) 。更多的 Tuj-1阳性神经元和相对较少的 GFAP 阳性星形胶质细胞在水凝胶内产生,三维环境赋予了被包裹的神经干细胞状态依赖性的细胞行为,以调节干细胞维持和神经元分化的协调性。此外,细胞内的钙信号在细胞功能和各种神经元的信号转导方面起着关键作用。为了确定从神经干细胞分化出来的神经元是否在3D 结构中起作用,研究在培养2周后进行了 Fou-4钙成像测试。将细胞与Fou-4 染料孵育后,用共聚焦显微镜监测荧光强度,并记录其对谷氨酸神经递质的反应。在添加谷氨酸67秒后捕获钙瞬变,这表明神经元功能活跃,能够通过自发活动传递信号。作为一种活性结构体,神经干细胞3D 水凝胶有望为其他神经元的粘附和生长提供一个合适的生态微环境,这可能会显著影响宿主和移植物之间的整合。

图3. 载有神经干细胞的生物3D打印体及表征。A)培养0天的生物3D打印载 NSCs
水凝胶的活(绿色)/死(红色)染色图像。B)在第0天(2小时) ,第1天,第3天和第7天培养的生物3D打印的 NSC
载体水凝胶中的细胞活性(%)。C)培养3天的载有 NSC 的生物3D打印水凝胶中的细胞骨架染色图像。D)培养7天染色的 DAPI (蓝色)
,Tuj-1(绿色)和 GFAP
(红色)的生物3D打印的含NSCs水凝胶图像。E-f)(d)中白色框选区的放大图像。G)培养14天的生物3D打印
NSC水凝胶内神经元的钙成像。相对神经活动显示为颜色编码,信号强度范围从黑色(非活跃)到白色(高活跃)。加入谷氨酸后测量和记录H)阳性细胞的荧光强度随时间变化。
体内免疫微环境的调节
将大鼠随机分为3组,将不含细胞3D水凝胶(支架组,S组)或载NSC-3D生物支架(载NSC支架组,SN组)植入病变部位填充空腔,以不植入任何内固定物的未处理脊髓损伤组作为对照组(SCI组)。脊髓损伤可能引起一系列炎症事件,并在损伤后7天达到高峰。在这种情况下,炎症微环境对于移植的神经干细胞在体内的存活及其长期的神经修复作用具有至关重要的意义。小胶质细胞/巨噬细胞是脊髓损伤后炎症过程中的关键调节细胞。因此,研究进行了 CD68免疫荧光染色来表征总巨噬细胞/小胶质细胞的活化,并与 CD206共标记,以定位 M2极化的巨噬细胞/小胶质细胞。巨噬细胞表型从促炎 M1向抗炎 M2的转变在指导组织修复中尤为重要。然而,这种转变在脊髓损伤中通常是停滞不前的。在该研究中,研究发现 S 组相比于比SCI组而言活性巨噬细胞数量显着减少,M2巨噬细胞比例显着增加,表明植入 ECM 样支架有利于炎症调节功能。这些结果可以通过植入的支架的机械性能,具有适当孔隙率和仿生ECM组分可调节巨噬细胞的浸润和极化来解释。与 S 组相比,SN 组活化的巨噬细胞数量显着减少,M2巨噬细胞百分比显着提高,表明活神经样纤维内的 NSCs 也显示出显着的抗炎功能,这可能是由炎性细胞因子和 NSCs 分泌的细胞因子之间的复杂相互作用引起。此外,先前的研究表明,核酸药物重编程的雪旺细胞可以通过增强的细胞间通讯促进巨噬细胞进入 M2表型,这证明了细胞间通信(cell-cell crosstalk)在调节免疫信号传导中的重要性。ECM 样水凝胶和负载的 NSCs 协同作用,导致损伤后免疫微环境中细胞-细胞通讯和细胞-生物材料相互作用的增强,这可以有效地指导募集的巨噬细胞进入 M2表型并减轻局部炎症反应。总的来说,活体神经样纤维通过水凝胶和 NSCs 对炎症微环境的协同反应呈现出突出的免疫调节功能,有助于加速从促炎症到抗炎的炎症状态,并将受损组织推向修复和再生。星形胶质细胞现在被认为是脊髓损伤后重塑的参与者,它可以被激活并对炎症环境作出反应。为了研究活体神经样纤维在急性炎症阶段如何调节星形胶质细胞,研究分别用胶质纤维酸性蛋白(GFAP)和 Iba-1标记星形胶质细胞和小胶质细胞/巨噬细胞。值得注意的是,在 SCI 组中,大量活化的星形胶质细胞已经迁移到病变部位并形成致密的壁状构造,并且创建了隔离相邻宿主脊髓和病变核心的栅栏样边界。这种由强烈激活的星形胶质细胞形成的壁状结构可能构成轴突生长的物理和化学屏障。相反,在 S 和 SN 组中,在病变边缘发现松散排列的星形胶质细胞以桥式模式连接宿主脊髓和植入物,表明星形胶质细胞由于抑制巨噬细胞活化处于幼稚状态而不是瘢痕形成状态。此外,这种桥状星形胶质细胞可以作为一个支持的备用轴突,有助于神经网络重建。

图4.
活体神经样纤维调节炎症反应。A-B)损伤后1周,三组受伤脊髓的前段、病变段和尾段的CD68(绿色)、 CD206(红色)和 DAPI
(蓝色)免疫荧光染色图像。C-D)定量检测 CD68阳性细胞密度、 M2巨噬细胞极化率。E)三组损伤部位的 DAPI (蓝色) ,GFAP
(白色) ,Iba1(红色)的免疫组织化学染色的图像。虚线标记了病变部位和宿主脊髓之间的边界。黄色五角星表示损伤部位。
重建新生神经元的生态微环境
由反应性胶质瘢痕分泌的硫酸软骨素蛋白聚糖(CSPGs)已被证明是轴突重塑的主要抑制剂,导致脊髓损伤后神经再生失败。研究进一步分析了CSPG对不同组中轴突生长锥的抑制作用,在损伤后12周,通过染色 CS-56来标记CSPG,并染色GAP43来标记轴突生长锥。在脊髓损伤组,大量CSPG沉积在损伤部位形成密集的化学屏障,阻碍宿主神经跨界生长进入损伤部位。此外,放大的图像表明,再生轴突停止在 CSPG 丰富的区域。这是因为轴突生长锥对微环境的特征高度敏感。一旦他们到达病变核心含有丰富的CSPG,他们停止生长和由于营养不良收缩成球。由于ECM样水凝胶的免疫调节作用,S组CS-56阳性面积明显减少,并且在损伤边界上观察到一些出芽的轴突。值得注意的是,SN组中CS-56阳性区域很少,而是以相对对齐的模式被高密度的 GAP43阳性轴突取代,这表明在病变部位正在进行较好的神经轴突再生。
由于新生神经元经历增殖,轴突延伸和神经网络形成,需要同步血管化来满足神经组织再生过程中营养物质和代谢交换的需求。因此,为损伤部位创造一个再生的神经血管生态微环境对于新生神经元功能化和组织再生至关重要。为了进一步了解活体神经样纤维的协同再生作用,通过在损伤后12周对 Tuj-1和大鼠内皮细胞抗原-1(RECA-1)进行免疫染色来观察新生神经元和血管。在 S 组和 SN 组的病变部位可以观察到更均匀分布的 RECA-1和 Tuj-1阳性细胞,表明新生神经元受到营养结构的支持。值得注意的是,SN 组的共焦 z 叠加图像显示有一些新生血管具有管腔样结构,在病变部位的新生神经元周围均匀再生,这为新生神经元向功能化方向发展奠定了基础。结果表明,活体神经样纤维通过减少抑制性化学屏障的产生和重建血管系统,优化了新生神经元的生态位,有助于维持其可持续的功能。

图5.
活体神经样纤维为新生神经元创造了一个合适的生态微环境。A)在伤后12周,在三组中代表性的低和高放大率免疫荧光图像的 DAPI (蓝色)
,GAP43(红色)和 CS-56(绿色)。B)损伤后12周,三组受损脊髓的前段、病变段和尾段的DAPI (蓝色) ,Tuj-1(红色)和
RECA-1(绿色) 代表性免疫荧光图像,黄色五角星表示损伤部位。虚线标记了病变部位和宿主脊髓之间的边界。C-d) SN 组病变部位的高倍 Z-
叠加图像; 箭头,具有管腔样的血管结构。
神经再生和髓鞘再生
对于打算脊髓损伤修复,损伤核心神经元的补充是神经回路重建的基础。为了鉴定和评估不同处理的完整横断脊髓的神经元再生能力,研究对神经元 III 类 β-微管蛋白(Tuj-1)进行免疫染色以显现新生神经元,生长相关蛋白-43(GAP43)以显现再生出芽轴突和神经丝200(NF)以检测成熟的神经纤维。SN组损伤部位有丰富的再生 Tuj-1阳性细胞,与 S组(P<0.01)和SCI组(P<0.001)相比显着增加。同时,S组由于ECM 样水凝胶的免疫调节作用,减少了瘢痕组织的形成,从而使多余的神经元迁移到损伤部位。而活体神经样纤维不仅为存活体神经元建立了良好的生态位,而且从原位神经干细胞的神经发生中补充了大量的神经元。轴突的生长方向是高度敏感的,并且通过整合外部线索使其终端树枝状朝向正确的目标。 SCI和S组相比,SN组中的GAP43阳性轴突以相对均匀和定向的模式排列,这可能是由于在印刷纤维中均匀分布的 NSCs 的高密度可以作为指导神经元通过直接接触或旁分泌手段延伸的方向。GAP43阳性轴突的定量分析表明,与SCI(P<0.001)和S组(P<0.001)相比,SN组具有最高的出芽轴突密度,这表明3D 打印的活神经样纤维提供的再生轴突的理想生态位(图6b8)。最重要的是,与SCI和S组相比,丰富的神经纤维不仅在病变边缘而且在病变核心处再生,并且在 SN组中连续分布(图6a9) ,表明活体神经样纤维的均匀,快速和强大的神经再生能力。这些结果表明,ECM样水凝胶和充足的神经干细胞组装的活体神经样纤维3D 为更好的神经再生提供了一个优越的平台。

图6.活体神经样纤维增强神经再生。A1-A3)损伤后12周,三组脊髓纵向切片的代表性免疫荧光图像,DAPI
(蓝色)与 Tuj-1(红色)共同染色。B1-B3)分别来自 A1、 A2、
A3的放大图像。A4-a6)损伤后12周,三组脊髓纵向切片的代表性免疫荧光图像,DAPI (蓝色)与
GAP43(红色)共同染色。B5-B7)放大图像分别来自
A4,A5,A6,伤后12周。A7-A9)损伤后12周,三组脊髓纵向切片的代表性免疫荧光图像,DAPI (蓝色)与 NF
(红色)共同染色。B9-A11)分别来自 A7、 A8和 A9的放大图像。B4) Tuj1阳性轴突密度的定量分析,B8)
GAP43阳性轴突密度和 B12) NF 阳性轴突密度(阳性免疫反应面积/总面积) ; n=5。
髓鞘包裹轴突,使轴突电绝缘,提高神经传导的速度和准确性,同时为轴突提供营养支持和保护,所以髓鞘再生在重建神经元信号转导系统中起关键作用。在损伤后12周,通过甲苯胺蓝染色和透射电子显微镜(TEM)分别检查所有组中神经损伤部位的半薄和超薄切片。在SN组中,大部分再生神经纤维被髓鞘包裹。相比之下,S组的神经纤维显示出大量的再生轴突,而髓鞘小而薄。此外,在脊髓损伤组,很少有再生轴突和髓鞘。定量分析显示,SN组有髓神经纤维密度(20225±2747神经/mm2)显着高于 S组(9092±3228神经/mm2,P <0.001)和 SCI组(2918±656神经/mm2,P<0.001)(图7c)。为了进一步评估再髓鞘形成的程度,使用 TEM 通过超微结构分析计算基于面积的 G 比率(轴突面积/整个有髓轴突面积) ,并通过箱形图(图7d)和散点图(图7e)呈现。SN 组面积比(0.42±0.06)显著低于S组(0.53±0.04,P<0.001)和 SCI组(0.61±0.44,P<0.001) ,表明髓鞘再生相对成熟。此外,与 S组和 SCI组相比,SN 组的再生神经纤维显示更大的有髓神经纤维,反映了活神经纤维的持续促髓鞘形成能力。然后,研究分别使用髓鞘基础蛋白(MBP,表示髓鞘)和 NF (表示神经纤维)在病变部位通过 IF染色纵向和横向切片观察轴突的髓鞘形成。在 SN 组中,纵切片的Z叠加共定位图像显示再生的神经纤维包裹着密集和有组织的髓磷脂,并且 z切片显示由髓磷脂环绕神经纤维组成的典型的“壳核”结构。相比之下,这种结构在 S 组中不太普遍,在 SCI 组中偶尔出现。这些结果提示支架移植能促进轴突再生,但再生轴突不足,髓鞘重建不足。同时,活体神经样纤维移植到损伤部位可显著促进轴突再生和髓鞘再生。

图7.活体神经样纤维促进髓鞘再生。A-B)分别在 SCI,S 和 SN
组的病变部位的横切片的甲苯胺蓝染色和 TEM
图像。C)来自甲苯胺蓝染色图像(数量/总面积)的有髓神经纤维密度的定量分析。D)透射电镜图像中基于面积的 G 比值的定量分析。E)来自 TEM
图像的G比与神经纤维面积的散点图; F) SN 组脊髓纵向和横向切片的代表性免疫荧光图像,共同染色 NF (绿色)和 MBP (红色)。G)
SN组纵向切片病变部位的高倍 Z- 叠加图像。
神经中继形成和功能性神经网络重构
外源性 NSCs 衍生的神经元可以通过形成突触连接作为宿主脊髓和病变部位之间的“信号中继站”,这被认为是严重 SCI 修复的有希望和有效的策略。损伤后12周,研究用 NF 和 SYN (突触前标记物突触素 I)标记受损脊髓的纵向冷冻切片,从而可视化再生神经纤维之间的突触形成。此外,在SN组中,GFP被用来区分移植细胞和宿主细胞。IF染色结果显示,移植到损伤部位的活体神经样纤维在整个损伤部位实现了广泛和强大的神经纤维再生。同时,在SN组病变核心有许多有序的 GFP/NF 共阳性(指移植来源的神经元)和一些 NF 阳性神经纤维(指宿主神经元)。这些纤维密切接触,并已检测到高密度SYN信号,表明新生突触来源于移植物和宿主神经元。透射电镜显示SN组再生突触的超微结构。此外,新生轴突中形成的再生突触百分比的定量分析显示 N (3.40±1.36%)和SN(10.79±3.62%)组之间有显著差异(P<0.001), SN组中的再生神经元具有改善的连接性。总的来说,这些结果表明,活体神经样纤维可以在病变部位建立外源性神经元中继,并与宿主神经元整合,有助于传递来自脊髓上下行通路的信号。
为了探索新生神经元网络的功能,研究通过染色胆碱乙酰转移酶(chAT) ,酪氨酸羟化酶(TH)和血清素(5-HT)分别鉴定了胆碱能,多巴胺能和5-羟色胺能轴突的再生。在SN组,结果显示在病变部位有大量可见的NF和ChAT双染色的轴突,并且大部分共表达GFP。同样,病变部位连续和丰富的 NF 阳性轴突显示TH和GFP阳性信号。此外,Z叠层图像显示,与移植物分化的5-HT阳性轴突在病变核心表现出大约260μm 的延伸。相比之下,其他组在损伤部位很少观察到功能性神经元的染色。上述结果表明,活体神经样纤维内的神经干细胞可分化为与运动和感觉有关的功能性神经元。此外,在 SN组的病变部位也观察到一些非 GFP表达的功能性神经元(即宿主细胞) ,这可能是由于移植的活神经样纤维提供的微环境改善,导致一些内源性功能性神经元的募集。

图8. 这些活体神经样纤维重塑了一个功能性的神经网络。A) SN
组脊髓纵向切片的代表性免疫荧光图像与 GFP (绿色) ,NF (红色) ,SYN (白色)共染色; A2-A5)来自(A1)的放大图像;
A6)染色 GFP (绿色) ,NF (红色) ,SN 组的 SYN (白色)。B) TEM 图像检测 SN 组的突触形成;
黄色箭头表示经典的突触结构; 黄色虚线矩形标记插入,显示突触结构的放大图像。C) NF 阳性细胞内突触形成比率的定量分析。n =
5.D1-d3)在 SN 组病变部位的 DAPI (蓝色) ,GFP (绿色) ,NF (红色)和 ChAT
(白色)免疫标记的代表性图像。D4-D6)在 SN 组病变部位的 DAPI (蓝色) ,GFP (绿色) ,NF (红色)和 TH
(白色)免疫标记的代表性图像,D7)在 SN 组病变部位的 DAPI (蓝色) ,GFP (绿色) ,NF (红色)和5-HT
(白色)免疫标记的代表性图像。E) SN 组 BDA
免疫染色矢状切片概述。E2-E4)分别在(E1)中放大了前段、病变段和尾段的图像。虚线标记了病变部位和宿主脊髓之间的边界。
功能恢复和安全评估
在 SCI 后,研究每周使用 Basso,Beattie 和 Bresnahan (BBB)评分来评估不同组大鼠的运动恢复情况(图9a)。与对照组(N组和SCI组)相比,SN组大鼠表现出统计学上显著的进行性运动恢复。此外,对于 SN组,手术后(0周)大鼠已经从完全瘫痪恢复,平均在伤后12周时偶尔承重背部踏步(中位BBB评分=9)。研究使用Catwalk 分析(图9b)和倾斜网格试验进一步评估了伤后12周自主和协调的运动功能恢复。SCI组大鼠的足迹显示出线状模式,表明后肢持续拖动(图9b) ,与网格测试结果一致,共同表现出运动功能的负恢复。然而,S组大鼠可以间歇性地将后肢抬离地面(图9b) ,并且在网格上爬行时呈现后肢适度的自主运动,而很少承重。值得注意的是,相比之下,SN组大鼠在 Catwalk 分析中表现出更明显的间歇性足迹(图9b) ,同时在爬坡过程中出现频繁的足底踏步和偶尔的前肢-后肢协调(图9c,视频 S3)。此外,在三个不同组的大鼠中进行经颅电生理测试以激发MEP,MEP是运动信号传导能力的可靠指标(图9d)。结果显示,按照SCI,S和 SN组大鼠的顺序,MEP幅度显着增加,而 MEP 潜伏期缩短(图9e-f) ,表明在 SN 组中,损伤部位的再生神经中继有效地促进了电信号的传导。总的来说,这些结果提供了活体神经样纤维移植能够使脊髓损伤后运动功能恢复的证据。
泌尿系统功能障碍是 SCI 常见但严重的并发症,并导致危及生命的后果。为了进一步研究不同治疗方法脊髓损伤后泌尿系统的变化,研究检查了大鼠膀胱和肾脏的病理学特征三组,伤后12周。结果表明,活体神经样纤维移植可以防止脊髓损伤大鼠膀胱粘膜水肿和肌束紊乱的病理损伤,这是由于其不仅在局部脊髓而且在全身具有显著的抗炎作用。肾组织的研究反映了类似的结果。这些研究结果表明,脊髓损伤大鼠活神经样纤维治疗,同时促进神经再生,也保护大鼠免受严重的泌尿系统并发症。

图9.活体神经样纤维促进功能恢复。A)运动-伤后每周后肢 BBB
评分。双向重复测量方差分析(方差分析)。* P < 0.05,* * P < 0.01,* * * P < 0.001; n =
8.B)猫步系统记录的有代表性的足迹。C)大鼠从底部向上爬时后肢的时间序列图像;
向上箭头表示时间序列的方向。D)代表性记录的皮层运动诱发电位(MEP)。E-f) MEP 幅度和潜伏期的定量分析; * P <
0.05,* * P < 0.01,* * * P < 0.001; n = 3。G)膀胱组织的H&E染色和 Mason
染色图像。
结论和展望
总的来说,生物3D打印的活体神经样纤维最大限度地发挥了神经干细胞在脊髓损伤修复中的治疗潜力。研究的研究结果提供证据表明,ECM样水凝胶保护外源性神经干细胞免受严酷的炎症环境,并为神经干细胞的长期存活,神经谱系分化和功能性突触形成提供了有利的生态微环境。此外,类 ECM水凝胶能够通过支持和粘附作用原位定位外源性神经干细胞,同时通过损伤部位的结构线索引导内源性神经元迁移。通过这种方式,宿主脊髓识别,接纳并整合外源性 NSCs衍生的再生神经回路,这表明3D打印的活体构建体可以在体内成熟为真正的活组织,实现了丢失组织的替换。由于三维生物打印活体神经样纤维的仿生结构和组成部分,ECM样水凝胶与携带的外源性神经干细胞协同作用,发挥出突出的生态微环境重建功能,协调有效的免疫调节、神经发生、血管形成、髓鞘再生、神经中继形成和神经回路重塑,共同促进了大段脊髓损伤修复和运动功能恢复。
参考文献
Yang J, Yang K, Man W, et al. 3D bio-printed living nerve-like fibers refine the ecological niche for long-distance spinal cord injury regeneration[J]. Bioactive Materials, 2023, 25: 160-175.
https://doi.org/10.1016/j.bioactmat.2023.01.023.
(责任编辑:admin)
最新内容
热点内容


 博世先进陶瓷公司使用Lith
博世先进陶瓷公司使用Lith Xenia进军大幅面增材制造
Xenia进军大幅面增材制造 研究人员基于3D打印冰模板
研究人员基于3D打印冰模板 美国Brooks与惠普合作开发
美国Brooks与惠普合作开发 《AHM》:3D打印为患者定
《AHM》:3D打印为患者定 MB Therapeutics与Lynxter
MB Therapeutics与Lynxter 美国空军引进3D砂
美国空军引进3D砂 3D打印个性化晶格
3D打印个性化晶格 伊犁州奎屯医院实
伊犁州奎屯医院实 昆士兰科技大学3D
昆士兰科技大学3D 全彩3D打印吉他在
全彩3D打印吉他在 PSAS成功发射3D打
PSAS成功发射3D打

