脱细胞椎间盘水凝胶对人骨髓间充质干细胞的组织特异性分化和再生研究
时间:2022-03-31 09:09 来源:生物打印与再生工程 作者:admin 阅读:次
细胞行为与其所处的微环境密切相关。不同组织呈现给驻留细胞的微环境也不尽相同,因而存在组织特异性。深入研究组织特异性与细胞行为的内在联系对于体外调控细胞行为和体内组织修复具有重要的指导意义。近日,来自华中科技大学的Shao
Zengwu & Lei Ming和中山大学的Quan
Daping团队通过将椎间盘内两块相邻的不同组织脱细胞并制成水凝胶,系统研究了人骨髓间充质干细胞在其中的组织特异性分化。研究发现,这种组织特异性分化不仅依赖于脱细胞组织基质的材料组成,还与其培养方式(2D还是3D)相关。通过对RhoA/LATS/YAP1信号通路的系统分析,研究人员发现YAP1的调控在组织特异性分化中具有重要作用。最后,研究人员评估了组织特异性在组织再生中的积极作用。
椎间盘退化(IDD)是影响骨骼肌系统功能的常见疾病之一。现有的临床治疗手段如手术治疗、局部封堵和保守治疗效果欠佳,亟需开发新的治疗策略。最近数十年,基于生物机械修复机制的生物材料治疗引起了研究人员的极大兴趣。用于椎间盘修复的主要生物材料包括不可降解的聚丙烯酸酯和聚丙烯酰胺以及可降解的透明质酸、胶原和壳聚糖。然而,这些植入材料往往不能很好地调控伤口微环境、组织退化、水分流失和炎症反应。到目前为止,利用生物材料实现椎间盘再生和恢复组织完整性还未取得令人满意的临床结果。
治疗IDD的另一种思路是细胞疗法。基于干细胞的细胞疗法在治疗IDD上已经取得了一些有益的结果。例如,体内注射间充质干细胞并将其分化为椎间盘细胞促进了椎间盘组织细胞外基质(ECM)的合成。然而,由于缺乏适宜的细胞载体材料,这种方法面临的最直接问题是低细胞存活率和干细胞分化不可控。大量研究表明,脱细胞组织基质(DTM)去除了免疫原性而保留了原有组织的大部分功能性成分(如细胞因子、基质结合纳米囊泡和蛋白)和3D超微结构,是一种理想的细胞载体材料。其中,DTM水凝胶不仅能够作为细胞的物理载体,还能通过其组织特异性调控细胞行为。椎间盘的主要功能构成包括髓核(NP)核纤维环(AF),而这两种相邻组织在组成和结构上存在差异。于是,研究人员提出一个问题:这种组织差异性能否特异性地诱导间充质干细胞向对应的组织进行分化?
另一方面,研究人员也注意到了细胞微环境的空间特征对干细胞行为的影响。例如,3D环境可提供额外的刺激以促进成骨分化。对于肌成纤维细胞的分化,2D和3D培养存在巨大差异。因为NP细胞和AF细胞在体内具有不同的空间特征,因此在研究干细胞的组织特异性分化时兼顾培养方式的影响也十分有必要。
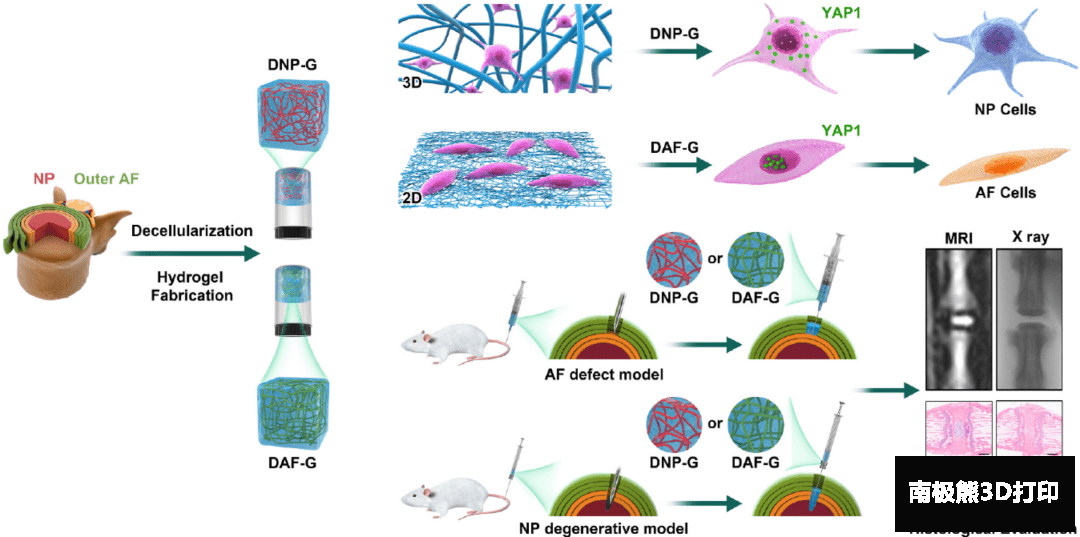
在这篇论文中,研究人员首先制备了脱细胞髓核和纤维环以及对应的水凝胶(DNP-G和DAF-G),并评估了脱细胞工艺和表征了水凝胶的基本性能。然后,研究人员利用蛋白组学工具分析了两种水凝胶的组成异同,并确定了差异组成和特异性标志物。紧接着,研究人员分别研究了人骨髓间充质干细胞(hBMSCs)在不同的水凝胶材料中的特异性分化。为弄清楚组织特异性分化的具体机制,研究人员对整合素介导的Rho/LATS/YAP1信号通路进行了重点分析。最后,研究人员还评估了这两种水凝胶在大鼠椎间盘模型中的组织特异性再生功能。图1给出了大致的研究思路和内容。
1.脱细胞及DNP-G和DAF-G的制备和表征
研究人员首先评估了脱细胞工艺。H&E染色和DAPI染色表明大部分细胞成分已被去除,而且残留DNA含量也降低至国际通用标准(50 ng/mg)以下,表明使用脱细胞工艺的有效性(图2a-c)。同时,在脱细胞过程中ECM主要成分胶原和糖胺聚糖(GAGs)得到了很好的保留(图2d-e)。扫描电镜(SEM)显示两种不同的DTM具有不同的微观结构:DAF的纳米纤维结构取向性和直径略高于DNP(图2f)。流变表征显示,DAF-G比DNP-G有更短的凝胶时间和更高的储能模量(图2g)。然后,研究人员利用蛋白质学分析确定了两种DTM蛋白组成和成分差异(图2h-i)。基于基因本体(GO)数据库的分子功能(MF)分析表明,DNP-G中的蛋白质丰度更高,并与GAGs结合、蛋白二聚活性、催化活性、结构分子活性和糖类衍生物结合等相关(图2j)。细胞活死染色和CCK8试验表明DNP-G和DAF-G均具有良好的细胞相容性,而皮下异种移植模型实验表明两种DTM引起的炎症反应不明显。

为了区分NP和AF两种细胞,研究人员首先确定了对应的特异性标志物。在研究DTM水凝胶对hBMSCs的定向分化之前,研究人员先考察了DTM溶液对hBMSCs定向分化的影响(Ⅰ型胶原为对照组)。通过S&O染色和免疫组织化分析,研究人员发现NP特异性标志物(CD24和COL2A1)的阳性染色在DNP组中更明显,而AF特异性标志物(COL1A1和TNMD)的阳性染色在DAF组中更明显(图3a)。上述结果说明DNP和DAF溶液具有诱导hBMSCs定向分化为NP何AF细胞的潜力。为进一步验证这种组织特异性分化,研究人员分析了特异性标志物在不同水凝胶和不同培养条件(2D和3D)下的表达,发现3D培养21天后NP标志物(COL2A1,CD24,KRT19,ACAN和NCAM1)在DNP-G中表达上调(图3b)。另外,免疫荧光染色、蛋白质印迹和灰度分析显示NP标志物GPC3的荧光强度和表达量强于其他组,特别是在3D培养环境下(图3c-d)。通过对比2D和3D培养环境下NP标志物的表达,研究人员发现DNP-G在3D环境下更能促进hBMSCs向NP分化(图3e)。基于蛋白组学的分析,研究人员推测这可能与DNP中的FGF18有关。FGFG18能够通过上调ACAN和COL2A1表达以促进软骨分化。另外,DNP除了含有多种生长因子外,还包含丰富的胶原如COL2A1、COL11A2和COL9A3。其中,Ⅱ型胶原能够促进间充质干细胞向NP分化。另一方面,健康的NP组织高度水合,从而在椎间盘发育过程中将NP细胞包裹在类似凝胶的微环境中。所以,DNP-G以3D方式培养hBMSCs更有助于其向NP细胞分化。
不同的是,DAF-G诱导hBMSCs向AF分化,特别是在2D环境下(图4a),而且2D培养下AF标志物TNMD的表达高于其他组(图4b-c)。对比2D和3D培养环境,hBMSCs在DAF-G 2D环境下能表达更多的AF标志物(图4d)。同样是基于蛋白组学分析,研究人员认为这与DAF中的TGF-β1有关,因为TGF-β1是一个维持AF细胞表型的有效因子(虽然它也能诱导NP分化)。另外,DAF-G中存在的Ⅰ型胶原能够促进间充质干细胞的AF分化。另一方面,天然AF组织具有层状结构特征,迫使AF细胞以伸展的形态嵌在片层之间,相当于AF细胞接种在基底表面。所以,DAF-G以2D培养hBMSCs有助于其向AF细胞分化。以上结果说明hBMSCs的组织特异性分化不仅取决于DTM的组成,还受其空间特征(培养方式)的影响。


整合素转导的Hippo/YAP1信号通路通过感知细胞粘附并将机械信号从胞外传递至胞内受体以调节细胞活动。然而,上述信号通路在DNP-G和DAF-G的组织和空间特异性中的具体作用还未被确定。研究人员首先利用免疫荧光染色表征了细胞的粘附特性,发现在DAF-G 2D培养条件下hBMSCs具有更大的细胞覆盖面积和黏着斑面积,说明DAF-G 2D能显著增强细胞-ECM粘附(图5a-b)。接下来,研究人员考察了4个整合素亚型的表达,发现整合素αⅤβ3在DAF-G 2D中表达显著上调,并导致下游的RhoA活性增强(图5c)。有研究表明,整合素αⅤβ3的活化能够增强Ⅰ型胶原的表达,从而有利于AF分化。而细胞骨架介导的Rho-GTP酶通过参与LATS1/2去磷酸化使YAP1分子活化以应答受整合素转化。蛋白质印迹表征显示LATS的磷酸化程度在DAF-G 2D中明显降低,说明Hippo通路未被激活,YAP1的磷酸化也因此下调并伴随YAP1退化的减弱(图5d)。上述结果说明,DAF-G 2D 的组成和空间特征激活了整合素αⅤβ3,促进了肌动蛋白相关的Rho-GTP酶的酶促反应,并导致了LATS介导的YAP1的去磷酸化(即活化)。接下来,研究人员分析了DNP-G 3D中YAP1的活性抑制机理。

椎间盘退化(IDD)是影响骨骼肌系统功能的常见疾病之一。现有的临床治疗手段如手术治疗、局部封堵和保守治疗效果欠佳,亟需开发新的治疗策略。最近数十年,基于生物机械修复机制的生物材料治疗引起了研究人员的极大兴趣。用于椎间盘修复的主要生物材料包括不可降解的聚丙烯酸酯和聚丙烯酰胺以及可降解的透明质酸、胶原和壳聚糖。然而,这些植入材料往往不能很好地调控伤口微环境、组织退化、水分流失和炎症反应。到目前为止,利用生物材料实现椎间盘再生和恢复组织完整性还未取得令人满意的临床结果。
治疗IDD的另一种思路是细胞疗法。基于干细胞的细胞疗法在治疗IDD上已经取得了一些有益的结果。例如,体内注射间充质干细胞并将其分化为椎间盘细胞促进了椎间盘组织细胞外基质(ECM)的合成。然而,由于缺乏适宜的细胞载体材料,这种方法面临的最直接问题是低细胞存活率和干细胞分化不可控。大量研究表明,脱细胞组织基质(DTM)去除了免疫原性而保留了原有组织的大部分功能性成分(如细胞因子、基质结合纳米囊泡和蛋白)和3D超微结构,是一种理想的细胞载体材料。其中,DTM水凝胶不仅能够作为细胞的物理载体,还能通过其组织特异性调控细胞行为。椎间盘的主要功能构成包括髓核(NP)核纤维环(AF),而这两种相邻组织在组成和结构上存在差异。于是,研究人员提出一个问题:这种组织差异性能否特异性地诱导间充质干细胞向对应的组织进行分化?
另一方面,研究人员也注意到了细胞微环境的空间特征对干细胞行为的影响。例如,3D环境可提供额外的刺激以促进成骨分化。对于肌成纤维细胞的分化,2D和3D培养存在巨大差异。因为NP细胞和AF细胞在体内具有不同的空间特征,因此在研究干细胞的组织特异性分化时兼顾培养方式的影响也十分有必要。
在这篇论文中,研究人员首先制备了脱细胞髓核和纤维环以及对应的水凝胶(DNP-G和DAF-G),并评估了脱细胞工艺和表征了水凝胶的基本性能。然后,研究人员利用蛋白组学工具分析了两种水凝胶的组成异同,并确定了差异组成和特异性标志物。紧接着,研究人员分别研究了人骨髓间充质干细胞(hBMSCs)在不同的水凝胶材料中的特异性分化。为弄清楚组织特异性分化的具体机制,研究人员对整合素介导的Rho/LATS/YAP1信号通路进行了重点分析。最后,研究人员还评估了这两种水凝胶在大鼠椎间盘模型中的组织特异性再生功能。图1给出了大致的研究思路和内容。

图1 DTM制备过程和体内外应用示意图
1.脱细胞及DNP-G和DAF-G的制备和表征
研究人员首先评估了脱细胞工艺。H&E染色和DAPI染色表明大部分细胞成分已被去除,而且残留DNA含量也降低至国际通用标准(50 ng/mg)以下,表明使用脱细胞工艺的有效性(图2a-c)。同时,在脱细胞过程中ECM主要成分胶原和糖胺聚糖(GAGs)得到了很好的保留(图2d-e)。扫描电镜(SEM)显示两种不同的DTM具有不同的微观结构:DAF的纳米纤维结构取向性和直径略高于DNP(图2f)。流变表征显示,DAF-G比DNP-G有更短的凝胶时间和更高的储能模量(图2g)。然后,研究人员利用蛋白质学分析确定了两种DTM蛋白组成和成分差异(图2h-i)。基于基因本体(GO)数据库的分子功能(MF)分析表明,DNP-G中的蛋白质丰度更高,并与GAGs结合、蛋白二聚活性、催化活性、结构分子活性和糖类衍生物结合等相关(图2j)。细胞活死染色和CCK8试验表明DNP-G和DAF-G均具有良好的细胞相容性,而皮下异种移植模型实验表明两种DTM引起的炎症反应不明显。

图2 DNP-G和DAF-G的成分差异、形貌和流变性能表征和蛋白组学分析
2. DNP-G和DAF-G对hBMSCs的定向分化为了区分NP和AF两种细胞,研究人员首先确定了对应的特异性标志物。在研究DTM水凝胶对hBMSCs的定向分化之前,研究人员先考察了DTM溶液对hBMSCs定向分化的影响(Ⅰ型胶原为对照组)。通过S&O染色和免疫组织化分析,研究人员发现NP特异性标志物(CD24和COL2A1)的阳性染色在DNP组中更明显,而AF特异性标志物(COL1A1和TNMD)的阳性染色在DAF组中更明显(图3a)。上述结果说明DNP和DAF溶液具有诱导hBMSCs定向分化为NP何AF细胞的潜力。为进一步验证这种组织特异性分化,研究人员分析了特异性标志物在不同水凝胶和不同培养条件(2D和3D)下的表达,发现3D培养21天后NP标志物(COL2A1,CD24,KRT19,ACAN和NCAM1)在DNP-G中表达上调(图3b)。另外,免疫荧光染色、蛋白质印迹和灰度分析显示NP标志物GPC3的荧光强度和表达量强于其他组,特别是在3D培养环境下(图3c-d)。通过对比2D和3D培养环境下NP标志物的表达,研究人员发现DNP-G在3D环境下更能促进hBMSCs向NP分化(图3e)。基于蛋白组学的分析,研究人员推测这可能与DNP中的FGF18有关。FGFG18能够通过上调ACAN和COL2A1表达以促进软骨分化。另外,DNP除了含有多种生长因子外,还包含丰富的胶原如COL2A1、COL11A2和COL9A3。其中,Ⅱ型胶原能够促进间充质干细胞向NP分化。另一方面,健康的NP组织高度水合,从而在椎间盘发育过程中将NP细胞包裹在类似凝胶的微环境中。所以,DNP-G以3D方式培养hBMSCs更有助于其向NP细胞分化。
不同的是,DAF-G诱导hBMSCs向AF分化,特别是在2D环境下(图4a),而且2D培养下AF标志物TNMD的表达高于其他组(图4b-c)。对比2D和3D培养环境,hBMSCs在DAF-G 2D环境下能表达更多的AF标志物(图4d)。同样是基于蛋白组学分析,研究人员认为这与DAF中的TGF-β1有关,因为TGF-β1是一个维持AF细胞表型的有效因子(虽然它也能诱导NP分化)。另外,DAF-G中存在的Ⅰ型胶原能够促进间充质干细胞的AF分化。另一方面,天然AF组织具有层状结构特征,迫使AF细胞以伸展的形态嵌在片层之间,相当于AF细胞接种在基底表面。所以,DAF-G以2D培养hBMSCs有助于其向AF细胞分化。以上结果说明hBMSCs的组织特异性分化不仅取决于DTM的组成,还受其空间特征(培养方式)的影响。

图3 DNP-G 3D培养诱导hBMSCs向NP细胞分化

图4 DAF-G 2D诱导hBMSCs向AF细胞分化
3. DAF-G 2D激活整合素介导的RhoA/LATS/YAP1信号通路整合素转导的Hippo/YAP1信号通路通过感知细胞粘附并将机械信号从胞外传递至胞内受体以调节细胞活动。然而,上述信号通路在DNP-G和DAF-G的组织和空间特异性中的具体作用还未被确定。研究人员首先利用免疫荧光染色表征了细胞的粘附特性,发现在DAF-G 2D培养条件下hBMSCs具有更大的细胞覆盖面积和黏着斑面积,说明DAF-G 2D能显著增强细胞-ECM粘附(图5a-b)。接下来,研究人员考察了4个整合素亚型的表达,发现整合素αⅤβ3在DAF-G 2D中表达显著上调,并导致下游的RhoA活性增强(图5c)。有研究表明,整合素αⅤβ3的活化能够增强Ⅰ型胶原的表达,从而有利于AF分化。而细胞骨架介导的Rho-GTP酶通过参与LATS1/2去磷酸化使YAP1分子活化以应答受整合素转化。蛋白质印迹表征显示LATS的磷酸化程度在DAF-G 2D中明显降低,说明Hippo通路未被激活,YAP1的磷酸化也因此下调并伴随YAP1退化的减弱(图5d)。上述结果说明,DAF-G 2D 的组成和空间特征激活了整合素αⅤβ3,促进了肌动蛋白相关的Rho-GTP酶的酶促反应,并导致了LATS介导的YAP1的去磷酸化(即活化)。接下来,研究人员分析了DNP-G 3D中YAP1的活性抑制机理。

图5 整合素αⅤβ3/RhoA/LATS/YAP1信号通路作用DTM诱导的组织特异性分化
4. YAP1对hBMSCs组织特异性分化的相反调控效应(责任编辑:admin)
最新内容
热点内容


 Himed评估不同喷砂磨料在3
Himed评估不同喷砂磨料在3 粉末粒径可以控制增材制造
粉末粒径可以控制增材制造 Divergent公司以3D打印技
Divergent公司以3D打印技 浙大口腔医学院:生物3D打
浙大口腔医学院:生物3D打 新型类器官样神经血管球促
新型类器官样神经血管球促 推动粘结剂喷射(铸造/金
推动粘结剂喷射(铸造/金 选区激光熔化增材
选区激光熔化增材 大型聚合物3D打印
大型聚合物3D打印 6K Additive最新
6K Additive最新 如何打造增材制造
如何打造增材制造 从实验室走向生产
从实验室走向生产 3D打印在口腔修复
3D打印在口腔修复

