医疗3D打印现状报告:产业进入落地期(3)
而3D打印器官组织的技术复杂性和道德伦理问题,目前仅局限于实验阶段。国外企业的发展遥遥领先于国内企业,如总部位于美国圣地亚哥的Organovo公司,产品包括微型肝脏、肝组织、迷你肾脏、肾组织、可移植肾脏、骨组织、肌肉组织、皮肤组织,已经实现了从内脏到皮肤、从组织到器官的全覆盖。其产品主要应用于临床研究阶段的药物开发和疗法测试,用于测试和确定药物对器官的影响,从而更快速有效地发现药物,降低药物研发成本。
四川蓝光英诺生物科技股份有限公司是国内专注于生物3D打印的代表性企业,其以干细胞应用技术研发为主,公司研发团队已经成功研制出3D生物打印血管并成功植入恒河猴体内,未来公司将加快推进干细胞技术走向临床,应用于器官修复和组织再造。

植入恒河猴体内的血管组织
图片来源:华西都市报
政策法规和认证体系逐步完善
政府一直以来非常重视3D打印在医疗行业的发展,2014年2月7日,国家食品药品监督管理总局颁布的《创新医疗器械特别审批程序(试行)的通知》,简化了3D打印产品的审批流程,以支持和鼓励医疗3D打印产品的创新。动脉网·蛋壳研究院梳理了近年有关政府扶持医疗3D打印发展的相关政策。
医疗3D打印相关政策
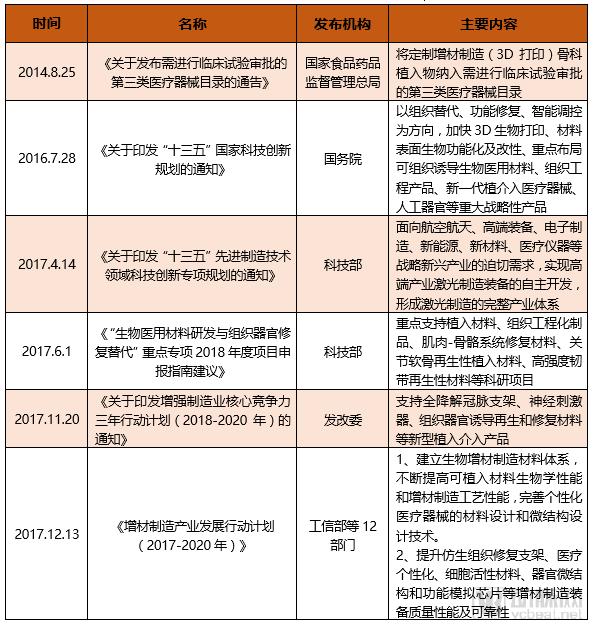
从政策发布机构看,国务院及国家食品药品监督管理总局、科技部、发改委等下属部门都明确提出要大力支持3D打印在医疗领域的应用,包括植入物、生物材料、组织器官等各个医疗3D打印应用领域。而且,国家食品药品监督管理总局还对医疗3D打印产品提出了明确要求,用以指导医疗3D打印产品的创新和发展。
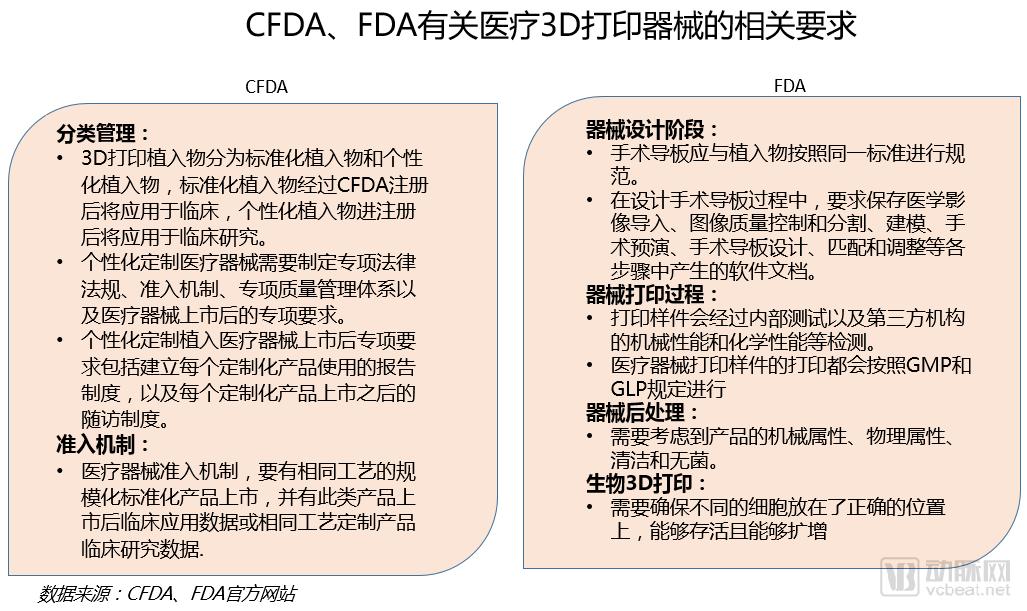
按照医疗器械的风险程度高低,CFDA针对医疗3D打印器械的主要按照第二、三类医疗器械进行分类管理。
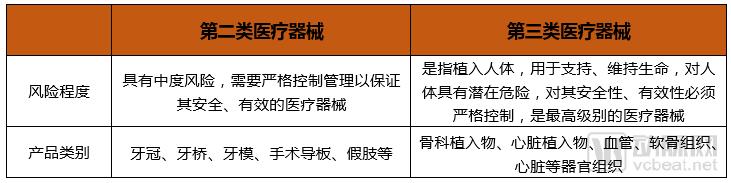
CFDA、FDA都对医疗3D打印器械的市场准入提出了严格要求,CFDA对医疗3D打印器械按照《医疗器械分类规则》进行分类管理,严格控制使用风险,特别重视对个性化植入物的监管,包括要制定专项法规、准入机制、质量管理体系,甚至上市后的报告和随访制度。而FDA对医疗3D打印器械的设计、打印以及后处理各个环节提出了不同要求,从源头上保证了产品的质量和安全性。同时,还对生物3D打印器械的功能提出了要求。
(责任编辑:admin)


 未来,3D打印将为供应链带
未来,3D打印将为供应链带 选区激光熔化SLM过程中打
选区激光熔化SLM过程中打 3D打印热潮已过,下步将如
3D打印热潮已过,下步将如 干货:3D打印在一汽大众汽
干货:3D打印在一汽大众汽 3D打印机为何能在环保问题
3D打印机为何能在环保问题 3D打印为供应链带来意想不
3D打印为供应链带来意想不 各类3D打印成型技
各类3D打印成型技

