同轴打印水凝胶支架缓释肝素结合表皮生长因子预防宫腔粘连
随着宫腔镜和刮宫术在妇科的广泛应用,宫腔粘连(IUAs)已成为妇科手术的主要长期并发症。约20%的流产女性会罹患此症。目前临床上鲜有能显著提高IUAs患者妊娠成功率的干预措施。因此,亟需开发能提升治疗效果、降低术后复发率的治疗新策略。
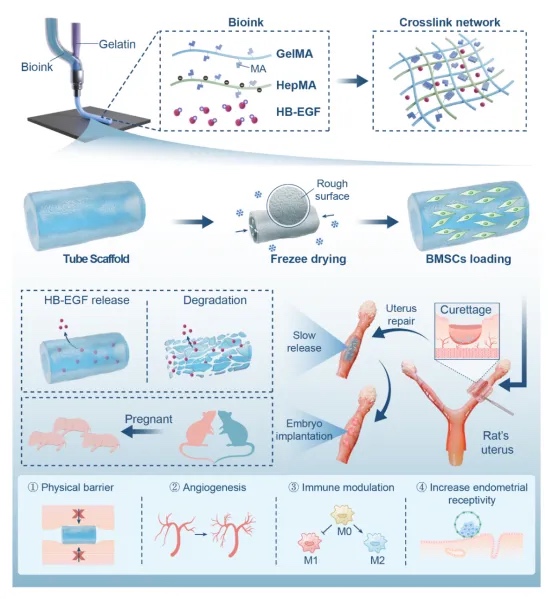
浙江大学贺永教授团队采用同轴3D打印技术开发了一种新型生物活性支架。该支架由明胶甲基丙烯酰(GelMA)-肝素甲基丙烯酰(HepMA)生物墨水构成,可通过静电作用结合肝素样表皮生长因子(HB-EGF)实现其可控释放。这一独特设计兼具双重功能:作为物理屏障预防损伤后粘连形成,同时作为生物活性递送系统通过促进新生血管化实现子宫内膜再生。研究进一步整合了骨髓间充质干细胞(BMSCs),通过将巨噬细胞极化为抗炎M2表型来调控局部免疫微环境。动物实验表明,该联合疗法能成功恢复子宫内膜容受性(表现为雌激素受体α(ERα)和孕激素受体(PR)表达恢复),最终在子宫损伤模型中实现妊娠成功。全面安全性评估证实了该疗法的治疗潜力。这种多功能支架通过同步解决子宫内膜修复的结构性、再生性和免疫性障碍,为宫腔粘连治疗提供了具有前景的新策略。相关工作以“Coaxial printing of slow-release heparin-binding epidermal growth factor scaffold to avoid the occurrence of intrauterine adhesions”为题发表在《Acta Biomaterialia》上。
研究内容
本支架采用同轴3D打印技术制备,由5% GelMA-30、0.5% HepMA和2μg/mL HB-EGF复合而成。通过静电作用将HB-EGF稳定结合于支架网络中,使其能够通过自释放和材料降解实现缓释。经冷冻干燥-潮化工艺优化后的支架具有理想的孔隙结构和表面粗糙度,可有效负载BMSCs。该支架不仅能作为物理屏障防止术后粘连,还能促进血管新生改善子宫内膜血供,通过免疫调节优化局部微环境,最终提高子宫内膜容受性,实现子宫内膜功能修复。
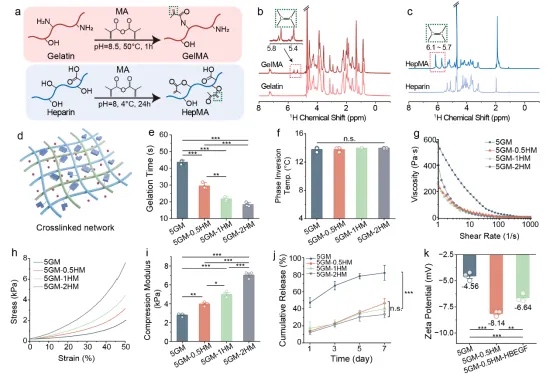
¹H NMR证实GelMA和HepMA合成成功。以5wt% GelMA为基础,加入0.5-2wt% HepMA构建双交联网络。光流变显示HepMA加速凝胶化且保持打印性能。5GM-0.5HM模量(3.05±0.64 kPa)与子宫组织(2.85±0.12 kPa)最匹配。含HepMA组7天HB-EGF释放率(40%)显著低于纯5GM组(80%)。Zeta电位证实HepMA通过静电调控释放。最终选择5GM-0.5HM,满足力学匹配、打印适性和控释三大需求。
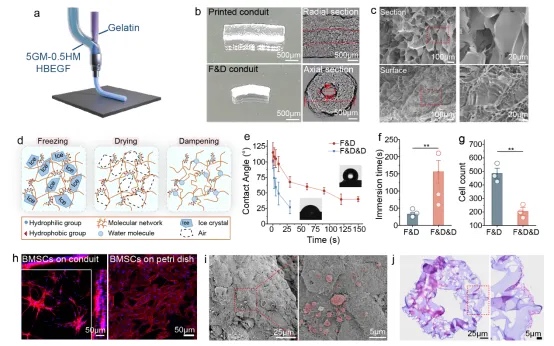
我们采用同轴打印技术制备明胶支架,尺寸匹配大鼠子宫。冷冻干燥后支架形成多孔结构但疏水性增强,经潮化处理(F&D&D)显著改善亲水性。接触角测试显示处理组液滴吸收时间远快于对照组。细胞接种实验证实F&D&D组细胞保留率更高。培养4天后,支架上BMSCs形成细胞簇并分泌胞外基质,SEM显示良好粘附和外泌体分泌,H&E染色表明多孔结构促进细胞附着和物质交换。
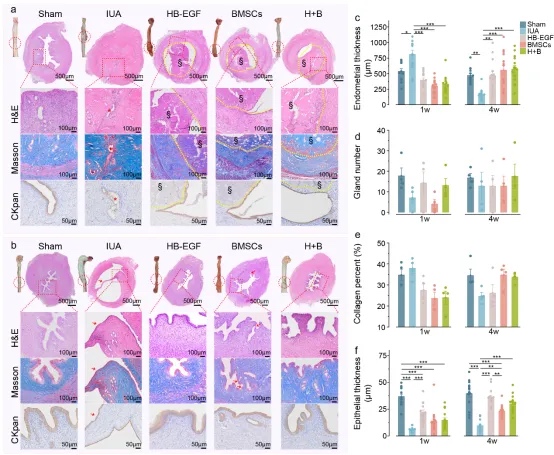
通过手术损伤大鼠子宫内膜基底层建立宫腔粘连(IUA)模型,评估负载HB-EGF、BMSCs及其联合治疗(H+B)的支架疗效。术后1周,IUA组出现致密粘连和上皮破坏,而治疗组通过支架物理隔离损伤面促进上皮再生。术后4周,IUA组发展为完全宫腔闭塞伴积液,而H+B组实现近乎正常的子宫修复,表现为单层上皮再生和纤维化消退。定量分析显示,联合治疗显著改善子宫内膜厚度、腺体数量和胶原沉积,优于单一治疗。结果表明,HB-EGF与BMSCs协同通过上皮保护和结构重建促进子宫内膜再生。
血管生成是子宫内膜修复的关键。术后1周,H+B联合治疗组形成规则血管网,而单药组仅产生不成熟微血管(6.47μm)。4周后,治疗组完成修复,但IUA组仍存在异常血管分布的纤维束。免疫荧光显示IUA组早期Col1A沉积显著。
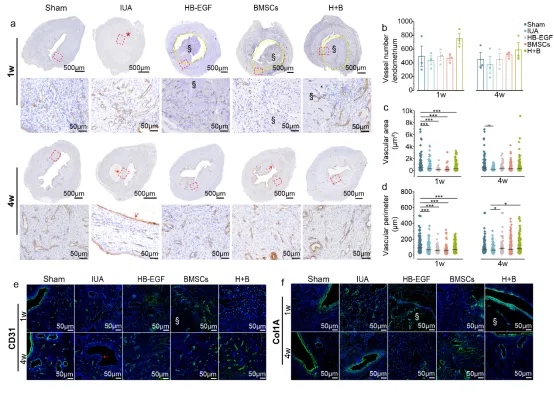
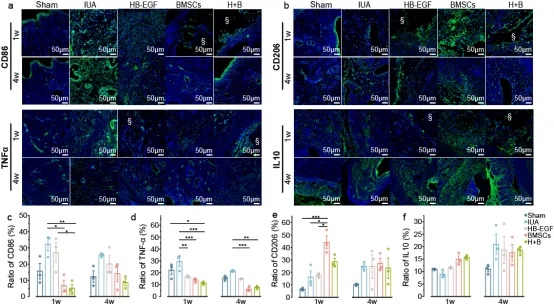
损伤后,巨噬细胞先分化为促炎M1型(CD86⁺/TNF-α⁺)清除坏死组织,后转为抗炎M2型(CD206⁺/IL-10⁺)促进修复。研究发现:术后1周,IUA组M1占主导,而BMSCs和H+B组显著增强M2极化。至4周时,BMSCs持续促进M2转化,形成促再生微环境,而IUA组仍以M1为主并伴随纤维化。证明BMSCs通过调控巨噬细胞极化改善子宫内膜修复。
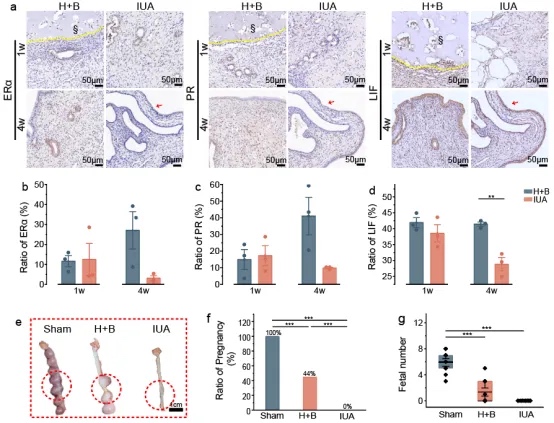
H+B联合治疗在子宫内膜修复中优于单一疗法,显著改善内膜厚度、腺体再生、纤维化抑制、血管生成及免疫调节。与IUA组相比,H+B组4周后完全恢复腺体结构,ERα和PR表达显著提升,而IUA组仍受纤维化抑制。白血病抑制因子(LIF)在H+B组正常定位于腔上皮,而IUA组则异常沉积于纤维束,影响胚胎着床。妊娠实验证实H+B组成功恢复子宫功能,实现胚胎植入。长期观察显示H+B组子宫结构完全修复,且无全身毒性,证明其安全有效。
研究内容
本研究开发了一种新型生物墨水配方,可构建结合生长因子和干细胞的生物活性支架,用于治疗严重受损的子宫内膜。该支架具有HB-EGF缓释特性,可预防IUA形成。胚胎移植成功证实该策略能恢复子宫功能。研究揭示了其有效的四大机制:1)支架作为物理屏障,减少早期修复阶段IUA风险;2)HB-EGF缓释促进血管新生;3)调控巨噬细胞向促修复的M2型极化;4)调节ERα和PR表达增强内膜容受性。安全性评估证实其治疗潜力。预防IUA对保护生育力、避免不可逆损伤、简化治疗及改善生殖健康至关重要。未来需进一步阐明内膜再生的具体机制,并优化制备工艺以推动临床转化。
文章来源:
https://doi.org/10.1016/j.actbio.2025.06.025
(责任编辑:admin)


 美国陆军3D打印“黑百合”
美国陆军3D打印“黑百合” 马里兰大学3D纳米打印技术
马里兰大学3D纳米打印技术 美军在黑鹰直升机飞行途中
美军在黑鹰直升机飞行途中 3D打印栖息地原型促进海洋
3D打印栖息地原型促进海洋 瞄准战乱地区需求,迈阿密
瞄准战乱地区需求,迈阿密 波音首次采用3D打
波音首次采用3D打 Contour3D在悉尼
Contour3D在悉尼 英国迈凯伦汽车与
英国迈凯伦汽车与 越南Vinmec医疗集
越南Vinmec医疗集 麻省理工和马萨诸
麻省理工和马萨诸 波士顿微制造推出
波士顿微制造推出

