微流控生物制造技术在骨转移建模中的研究进展
在癌症研究领域,骨转移机制解析与治疗策略开发依赖逼真的体外模型,而传统二维培养无法模拟天然三维骨微环境的细胞-细胞、细胞-细胞外基质相互作用及生物力学信号,动物模型则面临物种差异与伦理限制。来自华沙理工大学的Mehdi Khanmohammadi教授和Wojciech Swieszkowski教授团队,综述了微流控生物制造技术在骨转移建模中的研究进展,系统探讨了基于水凝胶的球形/纤维状模型、器官芯片平台(如血管化肿瘤模块、骨-肿瘤界面模型)的构建方法,以及动态流体调控、多细胞共培养在模拟转移级联中的应用。文中分析了现有技术在仿生基质设计、免疫细胞整合、高通量药物筛选中的突破与局限,并提出未来需通过多材料集成、生理力学信号模拟及患者来源细胞应用,构建更具临床相关性的骨转移微生理系统。相关工作以“Advances in microfluidic biofabrication technology for bone metastasis modeling”为题发表在《Biofabrication》上。

研究内容
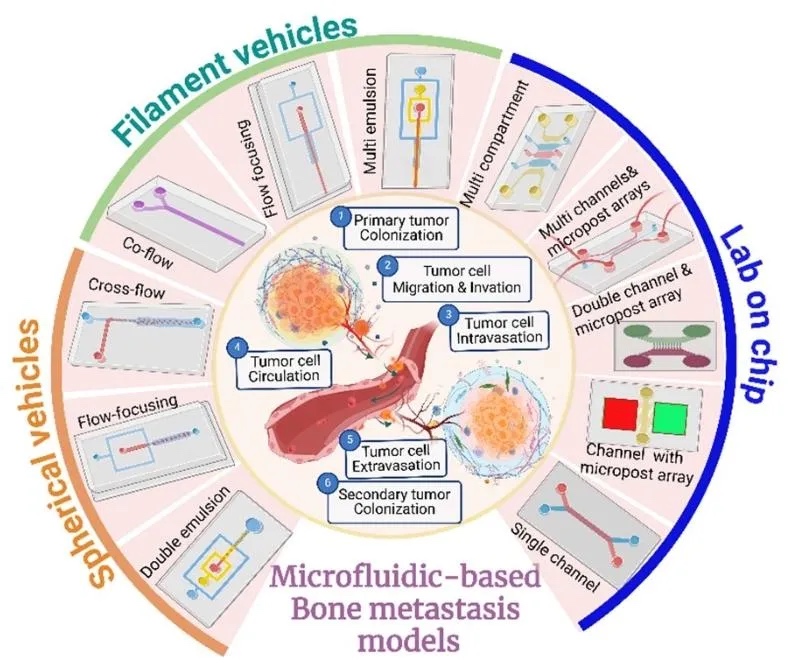
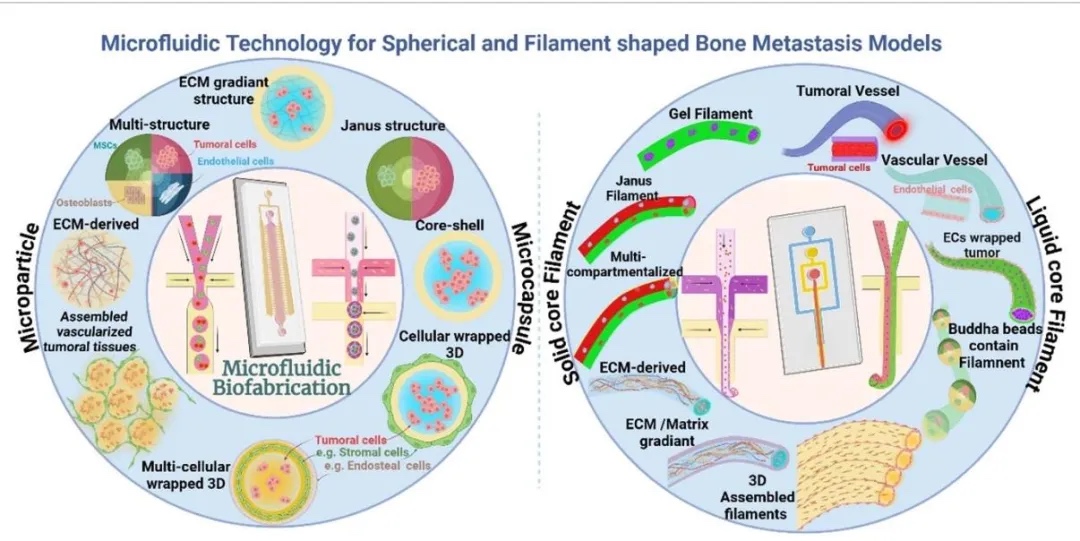
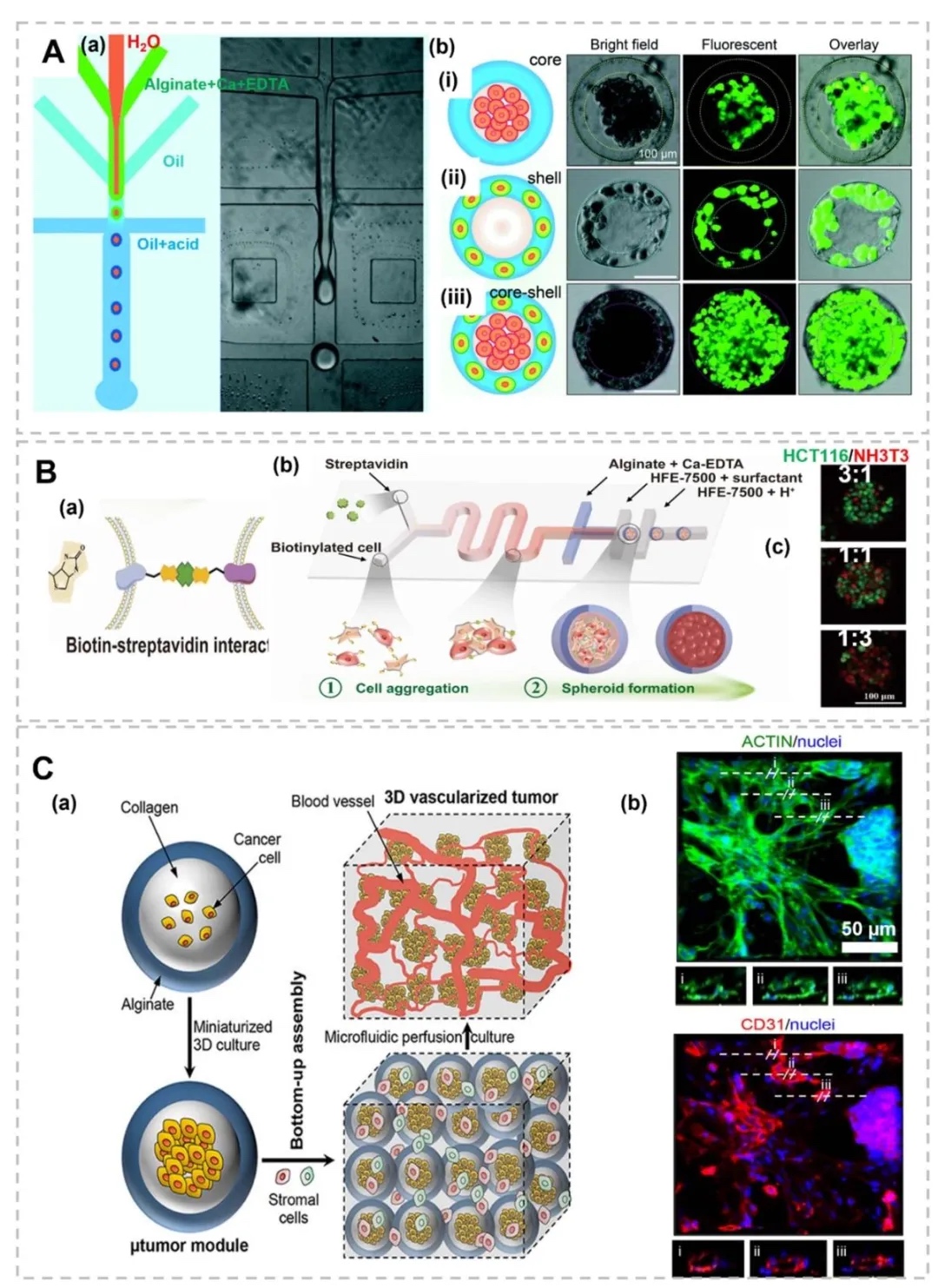
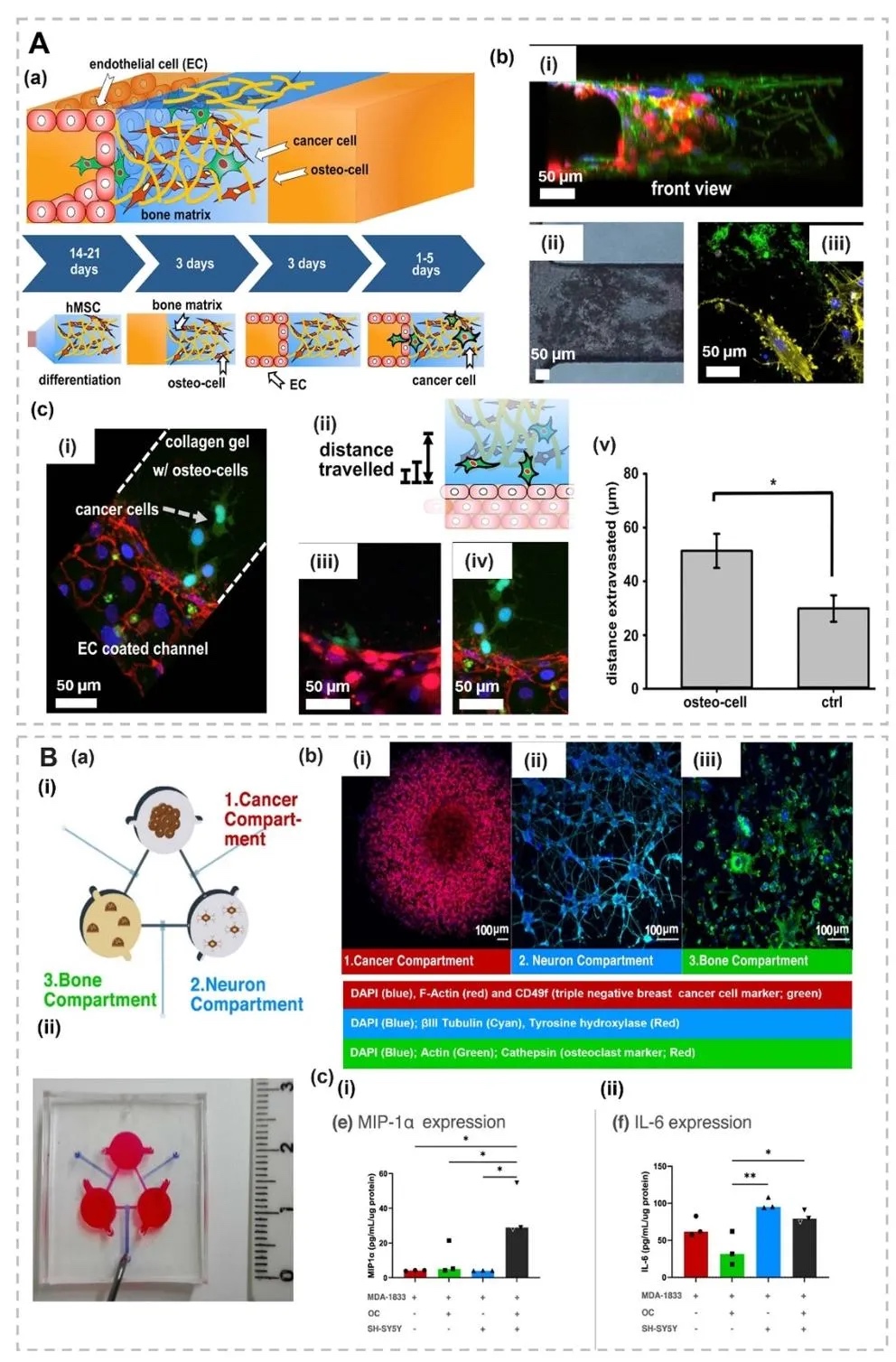
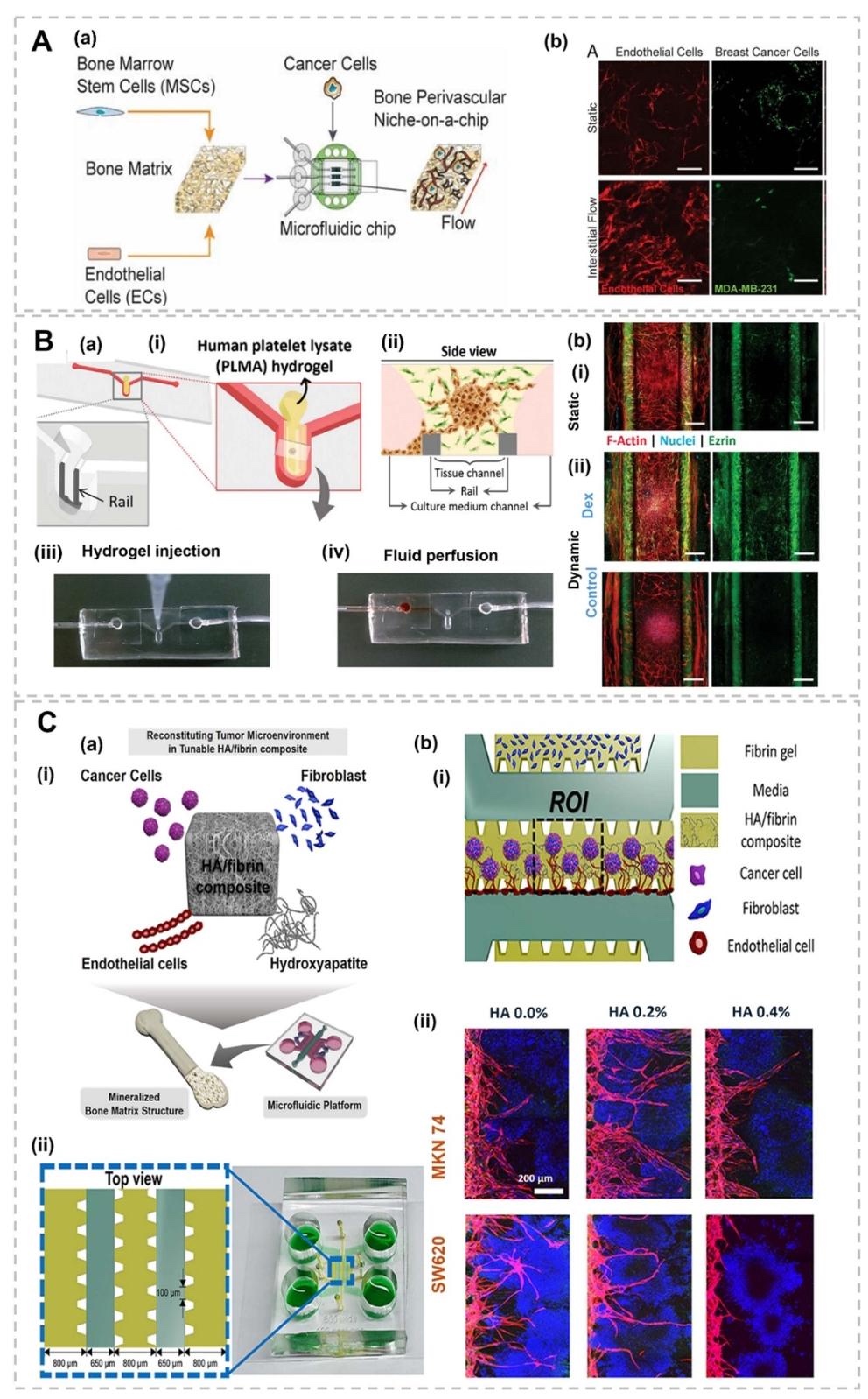
1. 微流控装置设计用于骨转移建模,图1展示了微流控技术构建的骨转移模型装置,包括球形载体(如微颗粒、微胶囊)、纤维状结构(实心芯、液体芯、多层微纤维)及器官芯片平台(带微孔阵列的双/三隔室芯片)。装置通过微通道内流体操控,模拟肿瘤微环境中细胞-细胞外基质相互作用及生物力学信号,支持多细胞共培养和动态梯度生成。
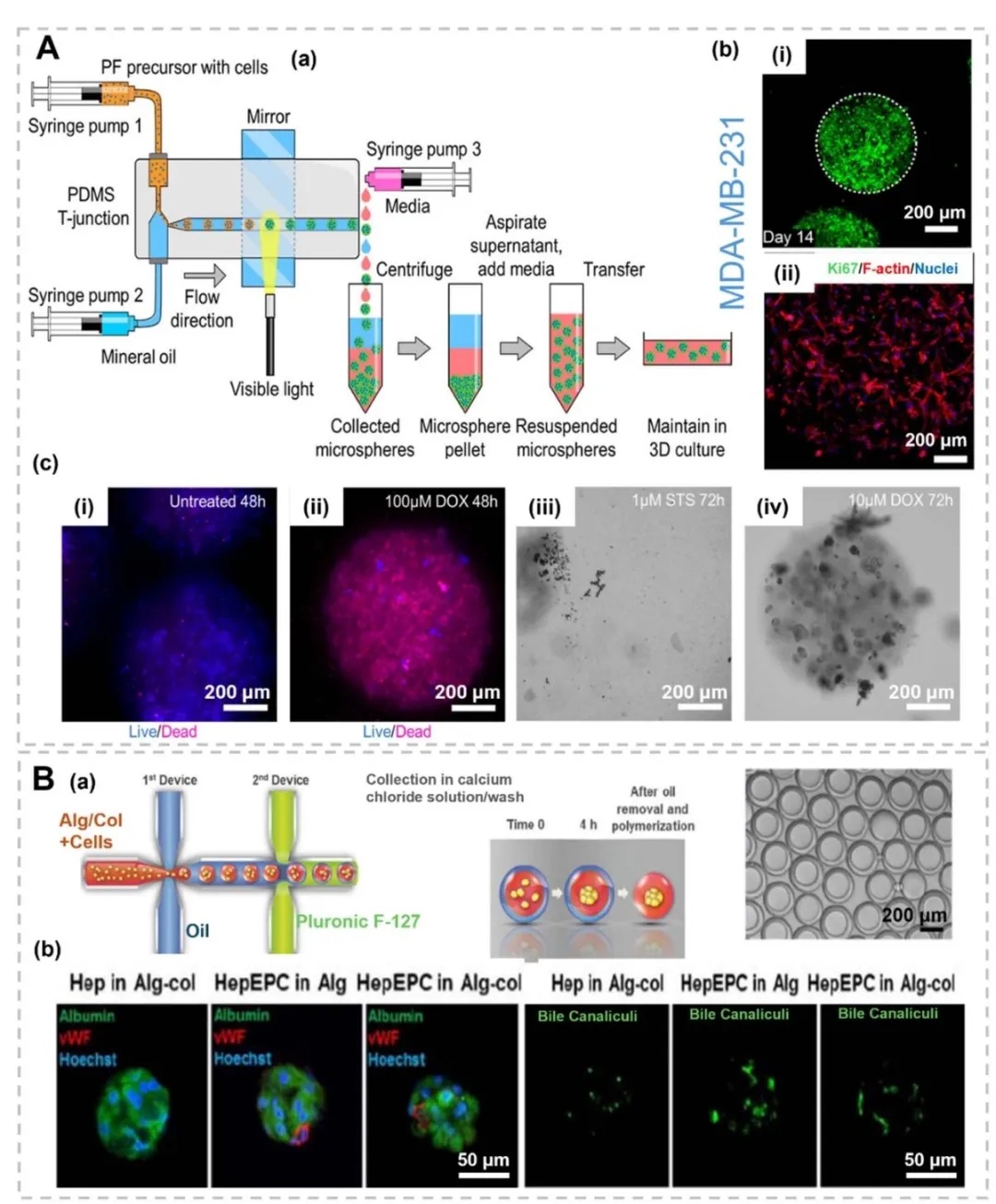
2. 三维球形肿瘤模型的制备与应用,图2呈现了水凝胶基球形模型(如微球、微胶囊),通过微流控芯片生成单分散微球,封装肿瘤细胞(如乳腺癌细胞MDA-MB-231)和基质成分(如PEG-纤维蛋白原)。模型可模拟肿瘤球体的营养梯度、药物响应及免疫细胞相互作用,例如图3中PF水凝胶微球经药物处理后,活/死染色显示细胞存活率与药物浓度呈负相关。
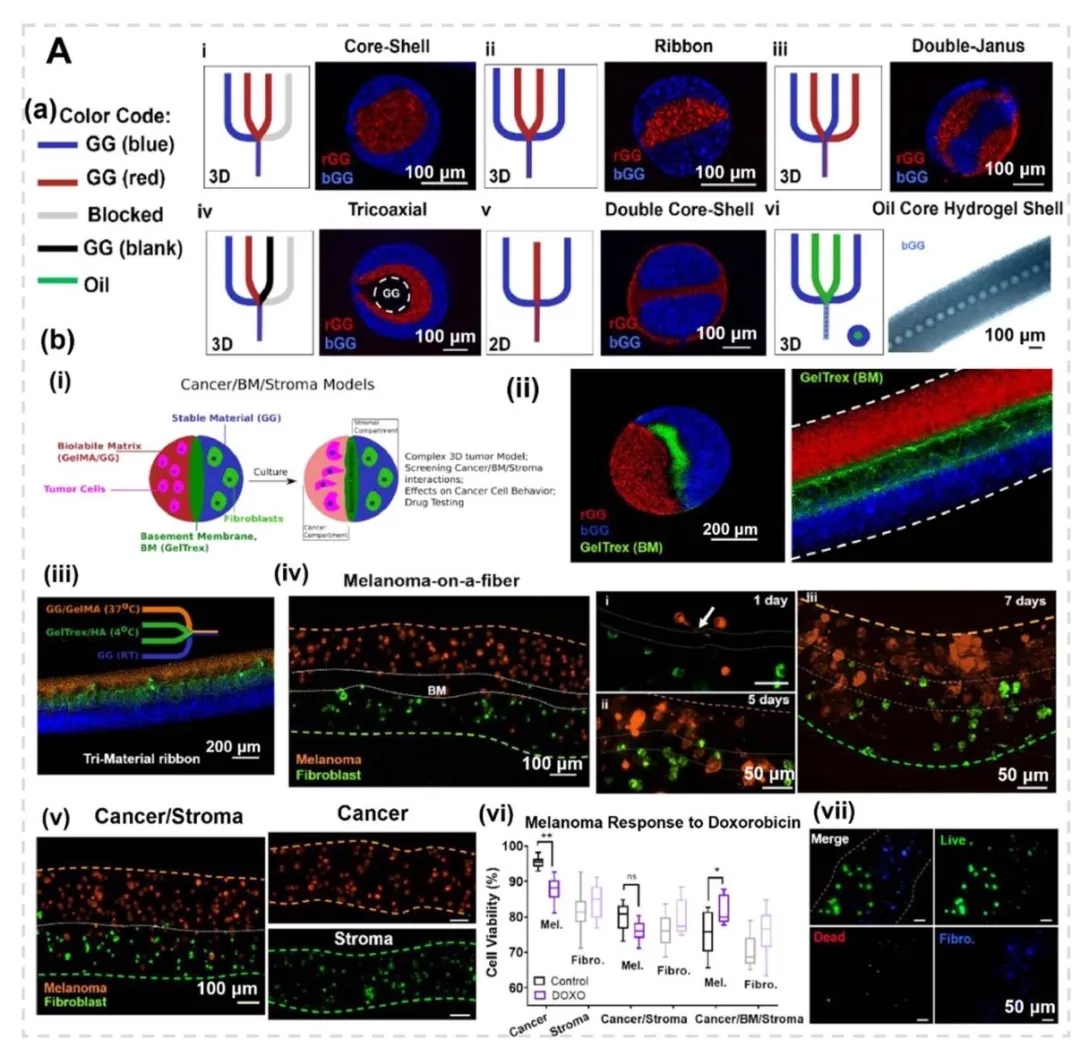
3. 多隔室球形与纤维状结构的仿生应用,图4展示了通过多流体电喷雾技术制备的双层、并列、三层结构微胶囊,用于封装不同肿瘤细胞(如MDA-MB-231、MCF-10A)和正常细胞(如肺成纤维细胞),模拟肿瘤微环境的空间异质性;图5呈现了核-壳微胶囊的水-水-油双乳液制备工艺,通过钙交联形成 Alg-Ca 凝胶壳,实现肝细胞与成纤维细胞的共培养。
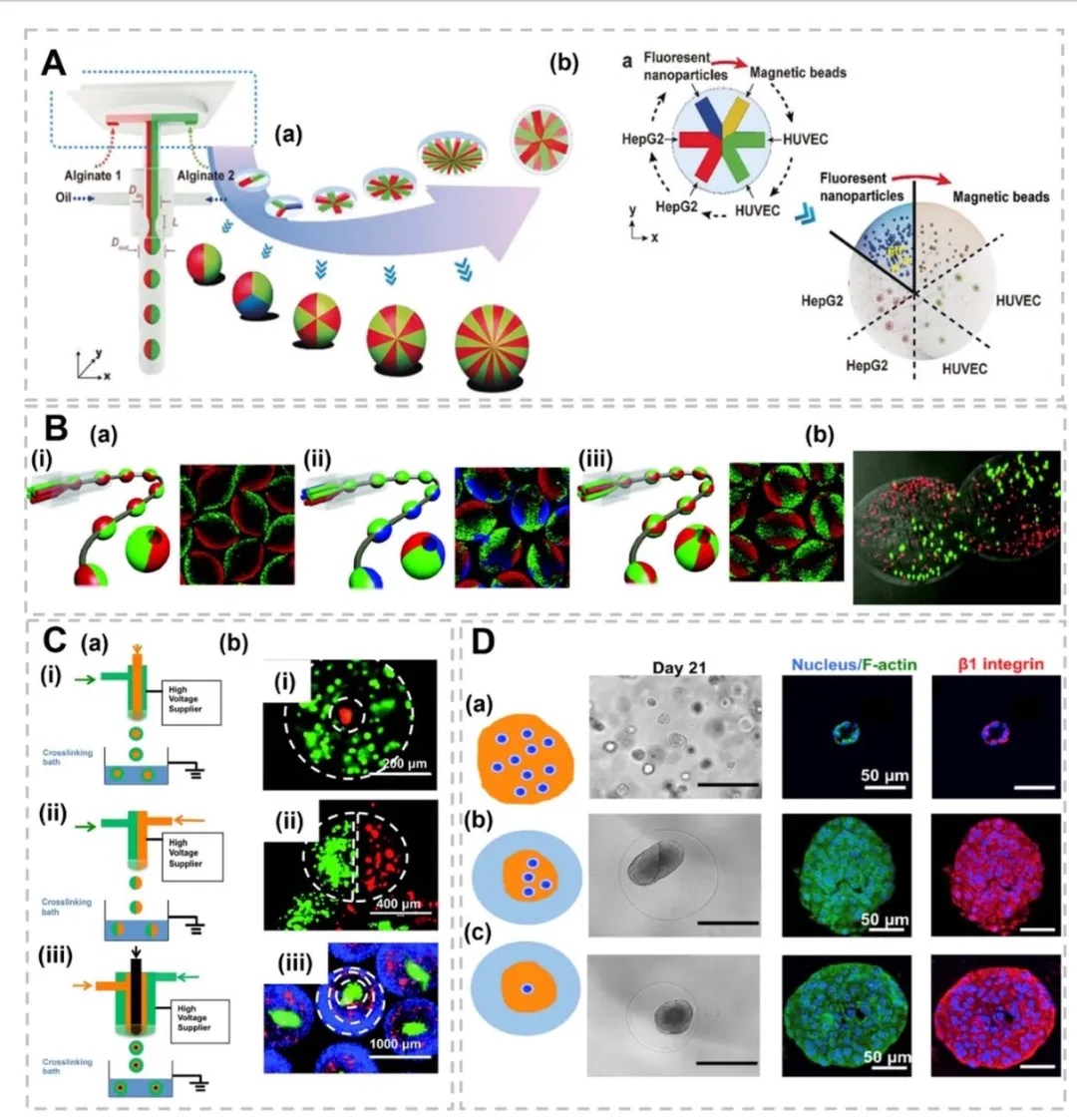
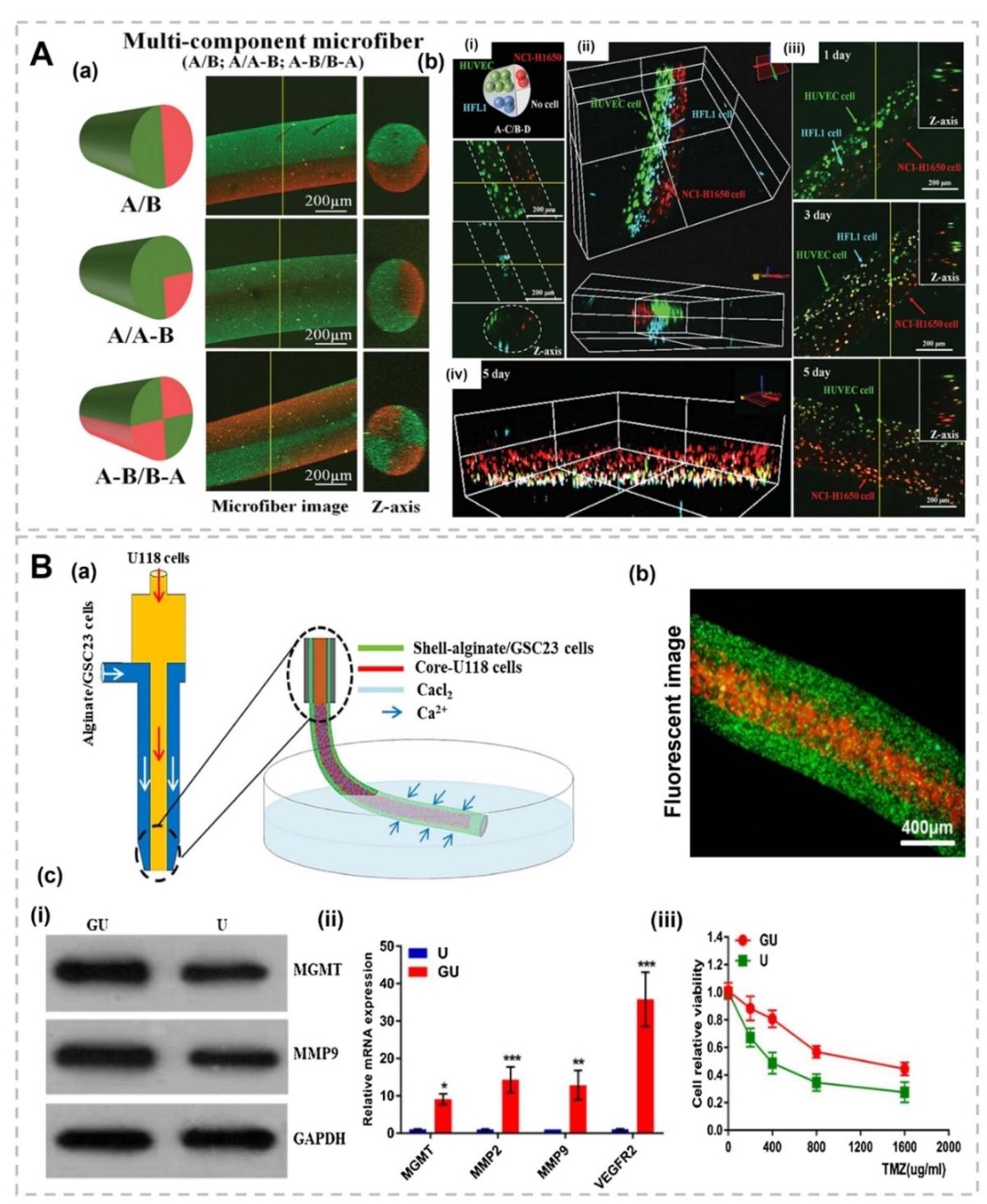
4. 纤维状结构与血管化肿瘤模型,图6展示了同轴挤出制备的壳-核水凝胶微纤维(如外层胶质干细胞GSC23、内核胶质瘤细胞U118),用于模拟肿瘤微环境的异质性;图7通过流聚焦技术构建多隔室纤维,模拟癌症-基底膜-基质的空间互作,揭示成纤维细胞密度对肿瘤球体生长的抑制效应。
5. 器官芯片平台模拟骨转移级联,图8和图10展示了多隔室器官芯片,其中图8的三通道芯片(肿瘤/血管/骨基质)通过流体剪切应力模拟,揭示CXCL5/CXCR2信号通路促进乳腺癌细胞外渗至骨基质;图10的三培养平台整合神经元、破骨细胞和肿瘤细胞,研究交感神经对骨转移的调控作用。
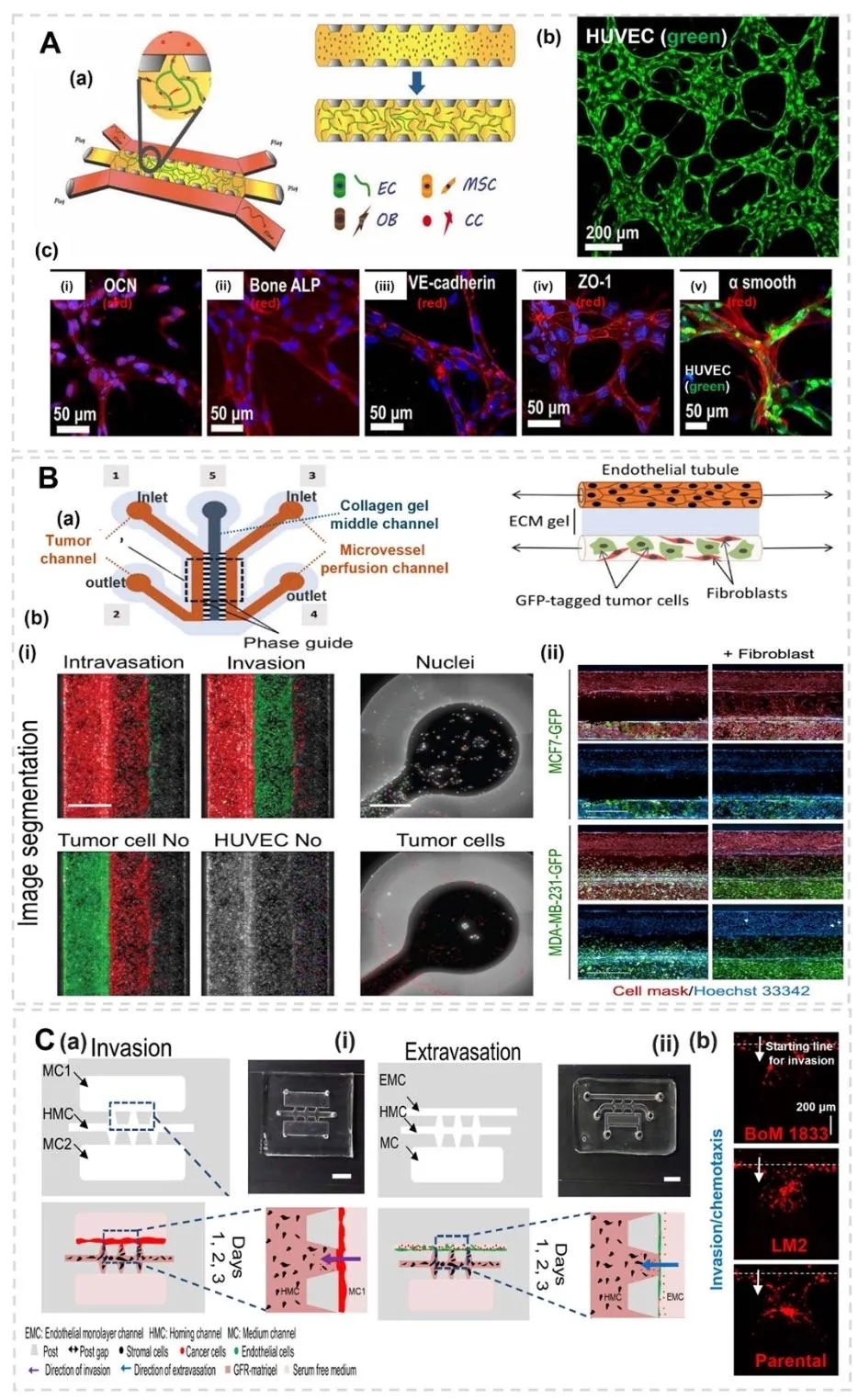
6. 骨血管周围微环境与药物响应建模,图9展示了骨血管周围(BoPV)微芯片,通过脱细胞骨基质与内皮细胞、间充质干细胞共培养,模拟骨转移的血管 niche。模型显示肿瘤细胞在间质流作用下增殖缓慢但药物抗性增强,验证了血管周围微环境对转移的支持作用。
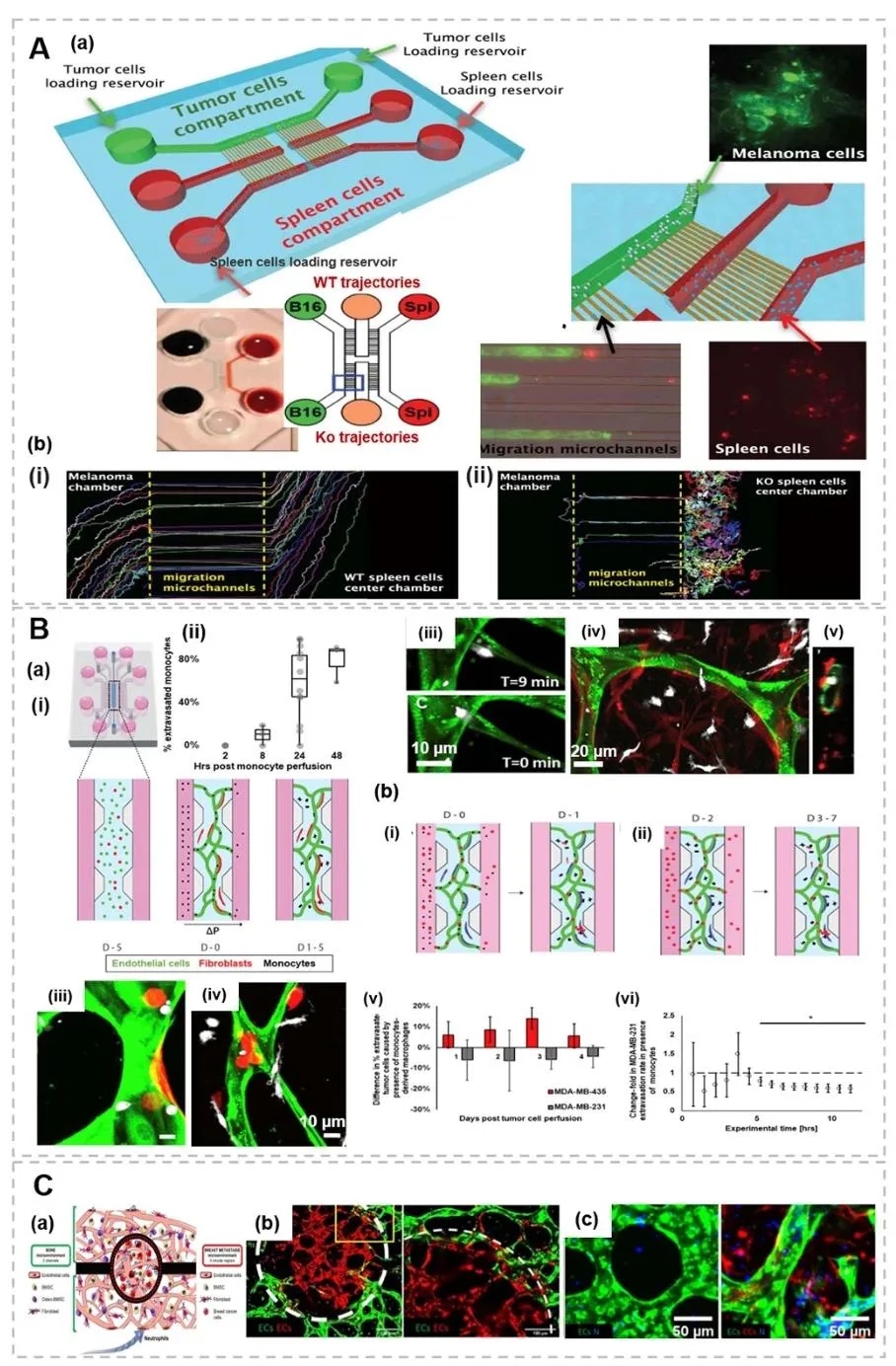
7. 免疫细胞与肿瘤转移的微流控模型分析,图11利用微流控血管网络模型,展示单核细胞通过增强内皮通透性促进肿瘤细胞外渗的过程。实验显示,与单核细胞共培养的肿瘤细胞外渗率显著提高,且细胞间相互作用通过TNF-α等炎症因子介导,揭示了免疫细胞在骨转移中的关键促转移作用。
研究结论
本研究表明,微流控技术通过精准操控流体、材料和细胞相互作用,为骨转移建模提供了革命性工具。传统二维培养和动物模型的局限性在三维微流控系统中得到显著改善,后者可模拟骨微环境的结构异质性、动态力学信号及多细胞交互。研究显示,基于水凝胶的球形、纤维状模型及器官芯片平台能有效再现肿瘤细胞黏附、外渗、血管生成等转移关键步骤,并支持药物筛选和机制研究。例如,血管化微流控模型揭示了CXCL5/CXCR2信号通路在肿瘤细胞骨定植中的作用,而免疫细胞整合模型则阐明了单核细胞对转移的促进效应。尽管现有技术在基质仿生和长期培养方面仍有不足,未来通过多材料集成、患者来源细胞应用及机械信号精准模拟,微流控平台有望构建更贴近临床的骨转移微生理系统,为个性化治疗开发提供关键支撑。相关成果为骨转移研究提供了跨学科视角,推动了肿瘤仿生模型向精准医学的转化。
文章来源:
https://doi.org/10.1088/1758-5090/add95f
(责任编辑:admin)


 ATU开发3D打印可穿戴能量
ATU开发3D打印可穿戴能量 威尼斯展会上展出两座模块
威尼斯展会上展出两座模块 3D打印微球-水凝胶支架促
3D打印微球-水凝胶支架促 骨内血管通路系统的临床突
骨内血管通路系统的临床突 增材制造革新海事产业:从
增材制造革新海事产业:从 突破性生物3D打印
突破性生物3D打印 迪拜LEAP 71公司
迪拜LEAP 71公司 3D生物打印构建内
3D生物打印构建内 《Small Science
《Small Science 南洋理工-剑桥大
南洋理工-剑桥大 清华大学:抗拉强
清华大学:抗拉强

