个性化增材制造医疗器械注册技术审查指导原则(2)
表1相关产品标准
|
标准编号 |
标准名称 |
|
YY/T 0316-2016 |
《医疗器械 风险管理对医疗器械的应用》 |
|
ISO 17296-2:2015 |
Additive manufacturing -- General principles -- Part 2: Overview of process categories and feedstock |
|
ISO 17296-3:2014 |
Additive manufacturing -- General principles -- Part 3: Main characteristics and corresponding test methods |
|
ISO 17296-4:2014 |
Additive manufacturing -- General principles -- Part 4: Overview of data processing |
|
ASTM F2924-12 |
Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium with Powder Bed Fusion |
|
ASTM F3001-14 |
Standard Specification for Additive Manufacturing Titanium-6 Aluminum-4 Vanadium ELI(Extra Low Interstitial)with Powder Bed Fusion |
|
ASTM F3091/F3091M-14 |
Standard Specification for Powder Bed Fusion of Plastic Materials |
|
ASTM F3049-14 |
Standard Guide for Characterizing Properties of Metal Powders Used for Additive Manufacturing Processes |
|
ISO/ASTM 52921:2013 |
Standard terminology for additive manufacturing -- Coordinate systems and test methodologies |
|
ISO/ASTM 52915:2016 |
Specification for additive manufacturing file format(AMF)Version 1.2 |
|
ISO/ASTM 52901:2017 |
Additive manufacturing -- General principles -- Requirements for purchased AM parts |
|
ISO/ASTM 52900:2015 |
Additive manufacturing -- General principles – Terminology |
(七)产品适用范围/预期用途
描述产品具体的使用部位、适用人群、使用情形、适应症和禁忌症、预期使用环境。明确操作该产品应当具备的技能/知识/培训。说明预期与申报产品配合使用的医疗器械的型号规格。
(八)产品风险分析资料
根据YY/T 0316-2016《医疗器械 风险管理对医疗器械的应用》,充分识别产品的个性化设计、原材料采购、生产加工过程、产品包装、灭菌、运输、贮存、使用等产品生命周期内各个环节的安全特征,从生物学危险(源)、环境危险(源)、有关使用的危险(源)、功能失效、能量危险(源)(若涉及)、老化及存储不当引起的危险(源)等方面,对产品进行全面的风险分析,并详述所采取的风险控制措施。
提供产品上市前对其风险管理活动进行全面评审所形成的风险管理报告,此报告旨在说明并承诺风险管理计划已被恰当地实施,并经过验证后判定综合剩余风险是可接受的,已有恰当的方法获得产品设计、制造、出厂后流通和临床应用的相关信息。
风险管理报告应当包括风险分析、风险评价、风险控制等产品风险管理的相关资料,至少应当包括产品安全特征清单、产品可预见的危害及危害分析清单(说明危害、可预见事件序列即危害成因分析)、危害处境和可能发生的损害之间的关系、风险评价、风险控制措施以及剩余风险评价汇总表。
(九)产品的研究要求
至少应当包含如下内容:
1.材料表征
结合材料属性和工艺流程,分别表征打印前、打印后和终产品材料的化学成分和组成、微观结构、力学性能等,明确各项性能指标的符合标准。
2.产品结构和机械性能
表征产品的结构。例如采用体视学方法、Micro-CT等表征3D打印多孔结构,明确关键特征参数,如孔单元形态、孔径大小及其分布、丝径、孔隙率、平均孔隙截距、孔隙渐变梯度、内部连通性、多孔结构的厚度等。
根据医疗器械的材料属性和预期用途,应当进行产品动静态力学性能测试,如刚度、屈服强度、极限强度、蠕变/粘弹性、疲劳和磨损等。个性化增材制造产品可以采用与传统制造工艺产品相同的测试方法,可根据产品适用的相关指导原则、标准要求确定需要的功能试验项目、试验方法。
应当使用等效模型进行机械试验。等效模型应当与申报产品经过所有相同的打印、打印后处理、清洗、灭菌等工艺步骤,且满足临床预期的结构和尺寸要求。提供等效模型确定的合理性论证,如使用3D计算机模拟(如有限元分析)等方法。
3.生物相容性
申报产品的生物相容性评价应当按照GB/T 16886.1—2011《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》中的系统方法框图及《国家食品药品监督管理局关于印发医疗器械生物学评价和审查指南的通知》(国食药监械〔2007〕345号)中的审查要点进行风险评价,在缺乏相关数据时,应当进行必要的生物相容性试验。
4.清洗和灭菌
清洗工艺验证和灭菌工艺验证应当根据产品特点选择最差情况,如清洗工艺验证中考虑材料残留,灭菌工艺验证中考虑表面积、孔隙率、孔径等影响微生物负载的因素。论证清洗验证方法的有效性,必要时应当采用破坏性试验对其清洗方法进行验证。考虑到增材制造工艺的复杂性,其多孔结构的清洗工艺验证应当由注册申请人完成。
对于经辐照灭菌的产品,需明确辐照剂量及相关的验证报告,具体的剂量确定依据可参照GB 18280系列标准。对于经环氧乙烷灭菌的产品,需提供灭菌结果确认和过程控制报告,具体可参照GB 18279系列标准。对于经湿热灭菌的产品,需提供灭菌工艺参数及验证报告,具体可参考GB 18278系列标准。
对于非灭菌包装的终产品,应当明确推荐采用的灭菌方法并提供确定依据,建议参考WS310.2-2016《医院消毒供应中心 第2部分:清洗消毒及灭菌技术操作规范》。采用其他灭菌方法的应当提供方法合理性论证和工艺确认及过程控制报告。
5.产品有效期和包装
申报产品应当参照现行有效的《无源植入性医疗器械货架有效期注册申报资料指导原则(2017年修订版)》(国家食品药品监督管理总局通告2017年第75号)提供产品货架有效期的验证资料。货架有效期验证资料中需要明确灭菌产品的包装材料、包装工艺及方法、加速老化试验或/和实时老化试验报告。加速老化试验中应明确试验温度、湿度、加速老化时间的确定依据。老化试验后需要对包装完整性和包装强度的评价试验,如染色液穿透试验、气泡试验、材料密封强度试验、模拟运输等。若申请人提供其他医疗器械产品的货架有效期验证资料,则应当提供其与本次申报产品在原材料、灭菌方法、灭菌剂量、包装材料、包装工艺、包装方式及其它影响阻菌性能的因素方面具有等同性的证明资料。不同包装、不同灭菌方式的产品应当分别提供验证资料。
对于非灭菌产品,货架有效期的确定应当建立在科学试验的基础上,如稳定性试验,其目的是考察产品在温度、湿度、光线的影响下随时间变化的规律,为产品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立产品的有效期。因此,申请人在申报产品注册时应当提供产品有效期的验证报告及内包装材料信息。
(责任编辑:admin)


 MGA医疗联盟:以系统化思
MGA医疗联盟:以系统化思 国家统计局:中国3D打印设
国家统计局:中国3D打印设 ICC将制定混凝土3D打印墙
ICC将制定混凝土3D打印墙 三项增材制造金属粉末国家
三项增材制造金属粉末国家 工信部等新规:工业级3D打
工信部等新规:工业级3D打 2027年产值突破1500亿元(
2027年产值突破1500亿元( 洞察2023:全球药
洞察2023:全球药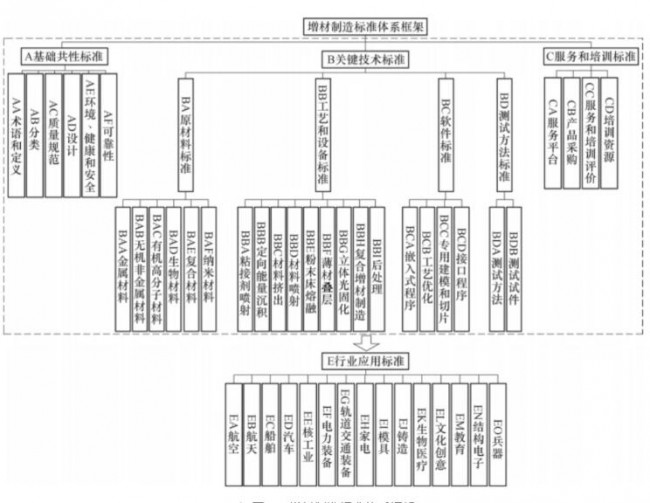 3D打印-增材制造
3D打印-增材制造 《智能制造知识体
《智能制造知识体 2021年中国及31省
2021年中国及31省 全球工程标准协会
全球工程标准协会 毛孔的SLM金属3D
毛孔的SLM金属3D

